¿Qué sería del planeta Tierra si no hubiera moléculas de oxígeno (O2)? Quizá no sea una de las preguntas que nos hemos planteado con frecuencia, ya que se asume que la vida se asocia por completo con esta molécula, y en efecto, sin ella la mayor parte de los macroorganismos desaparecería puesto que somos aerobios, es decir, utilizamos O2 como agente oxidante en los procesos metabólicos para obtener energía (ver www.revistac2.com/bichos-camara-accion-i-los-fermentadores/). Sin embargo, existen organismos capaces de vivir sin O2 que, de hecho, constituyen la mayor abundancia y diversidad en el planeta. Y se preguntará, ¿cómo viven?, ¿cómo llevan a cabo sus procesos metabólicos?, ¿qué agentes oxidantes emplean?, ¿de dónde los obtienen?… ¿Podría tratarse un derrame petrolero con agentes oxidantes “leves”, menos oxidantes que el mismísmo oxígeno?
Para responder a estas preguntas, comenzamos por definir la respiración: es un proceso metabólico de oxidación completa de compuestos orgánicos e inorgánicos que, por tratarse del rompimiento de enlaces químicos, “mueve” electrones y genera energía. Para llevar a cabo este proceso se requiere de agentes oxidantes; el oxígeno es el aceptor de electrones más común y es un compuesto con elevado potencial redox (+800 mV), que indica la tendencia de las especies químicas para adquirir electrones; por lo tanto, el oxígeno es de los agentes oxidantes que genera mayor rendimiento energético.
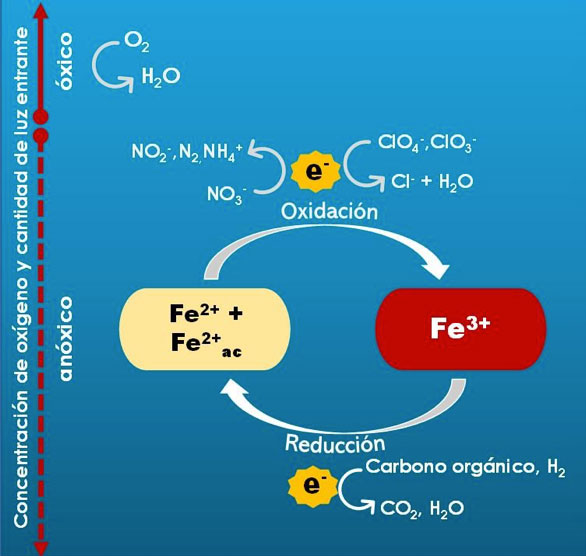
Pero no solo la sal sala y el oxígeno oxida. Existen otros agentes oxidantes de los cuales se puede disponer dependiendo de las condiciones del ambiente (siendo el potencial redox y el pH los factores que más influyen), como los sulfatos (SO42-), el manganeso (Mn+), nitratos (NO3–) o el hierro en su forma oxidada, el ion férrico (Fe3+), entre otros. Estos iones se encuentran en minerales, sedimentos, suelos o cuerpos de agua, humedales y a la espera de ser empleado uno u otro, como agente oxidante en la respiración de ciertos microorganismos; a esta respiración se le conoce como anaerobia. Curioso, pues pese a ser la más diversificada, la respiración anaerobia integra subtipos que lo único que tienen en común es que el oxígeno no participa como agente oxidante. También son más variados y más abundantes los ambientes donde sucede.
Debido a la diversidad de condiciones con las cuales se puede dar la respiración anaerobia, el nivel de competencia entre los microorganismos que la llevan a cabo es bajo, puesto que no necesariamente coexisten; por ejemplo, en ambientes muy reductores (-0.3 V) el azufre está disponible mayoritariamente en forma de sulfatos, que puede ser aprovechado por las bacterias sulfatorreductoras como Desulfovibrio desulfuricans (Fig. 1a), entre otros microorganismos; en cambio, la respiración de Fe3+ se favorece en ambientes con un potencial redox ligeramente oxidante (aproximadamente 0.05 V) donde actúan por ejemplo, bacterias del género Geobacter (Fig. 1b) o Shewanella (Fig. 1c), o las Archaea Ferroglobus spp. (Fig. 1d).
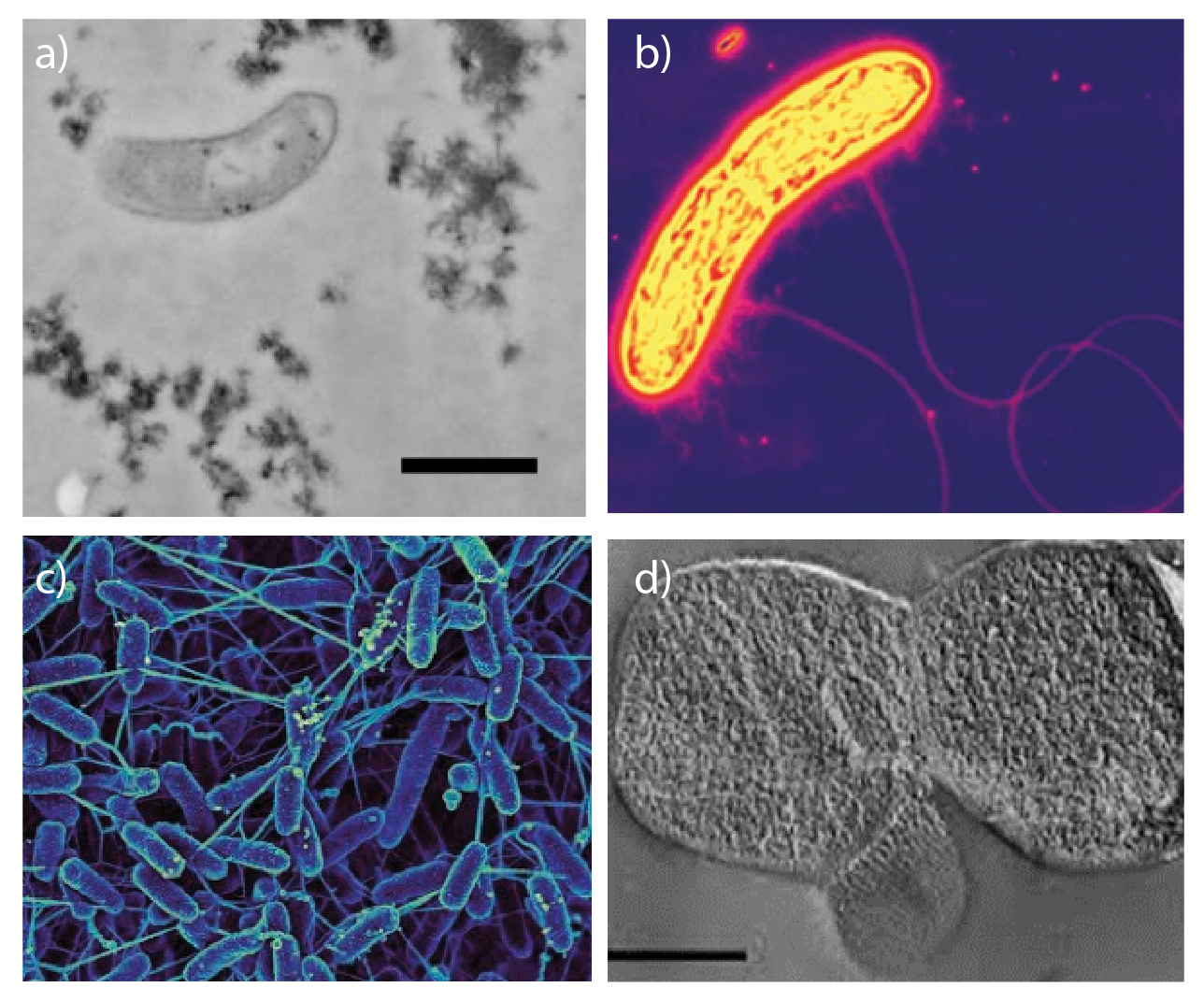
Entonces, a la pregunta de sí podría tratarse un derrame petrolero sin oxígeno pero con otros agentes oxidantes, menos oxidantes que el mismísmo oxígeno. En efecto, la respiración de Fe3+ permite utilizar microorganismos para la remediación de derrames petroleros. Como indica el pie de la Figura 1, algunas especies respiradoras de Fe3+ son capaces de oxidar compuestos aromáticos tales como el tolueno, benceno y fenol (que, cabe destacar, son compuestos altamente tóxicos debido a sus fuertes enlaces difíciles de romper y algunos de ellos son cancerígenos) hasta que solamente quedan residuos de carbono, “limpiando” el medio.
Así, enfocándonos únicamente en la respiración de Fe3+, ésta consiste en la oxidación de compuestos inorgánicos u orgánicos, como los derivados de la fermentación (ácido acético o vinagre) e incluso, compuestos complejos como los aromáticos citados, lo que provoca la reducción del Fe3+ a ion ferroso, Fe2+ (Ec. 1).
CH3COO– + 8Fe3+ + 4H2O → 2HCO3– + 8Fe2+ + 9H+
(Ecuación 1)
Desde el origen de la vida y considerando que en el planeta de entonces el potencial redox era bajo debido a la presencia de agentes oxidantes débiles (no había suficiente oxígeno), los microorganismos aprendieron a utilizar los elementos “disponibles” de ¡minerales insolubles! Y es que, pese de ser un elemento abundante, el hierro forma compuestos insolubles en ambientes anóxicos a pH > 4.0. Estando así, insolubles, las reacciones catalizadas dentro de la célula solo son una dificultad. La innovación evolutiva de algunas bacterias fue el desarrollo de un mecanismo de transporte de electrones extracelular mediante la participación de citocromos y lipoproteínas de la membrana celular (Fig. 2); además, en la membrana externa se encuentran unas estructuras proteicas llamadas pili, capaces de detectar y reconocer ambientes con alta concentración de Fe3+ y que pueden transportar electrones (Fig. 2; ver: https://www.revistac2.com/las-bacterias-tambien-corren/). Por tanto, es posible utilizar los electrones de compuestos insolubles de Fe3+ para la respiración ¡sin ser necesario que ingresen al interior de la célula! Y si los pili no logran conectarse al aceptor de electrones pero en el ambiente hay óxidos de Fe3+ en solución coloidal, el sistema coloidal actúa como conductor de electrones hasta el aceptor. Cabe agregar que la respiración de compuestos de Fe3+ significó un gran salto evolutivo en los procesos metabólicos, puesto que dio pie a la reducción de otros metales como el uranio o el manganeso para la obtención de energía.
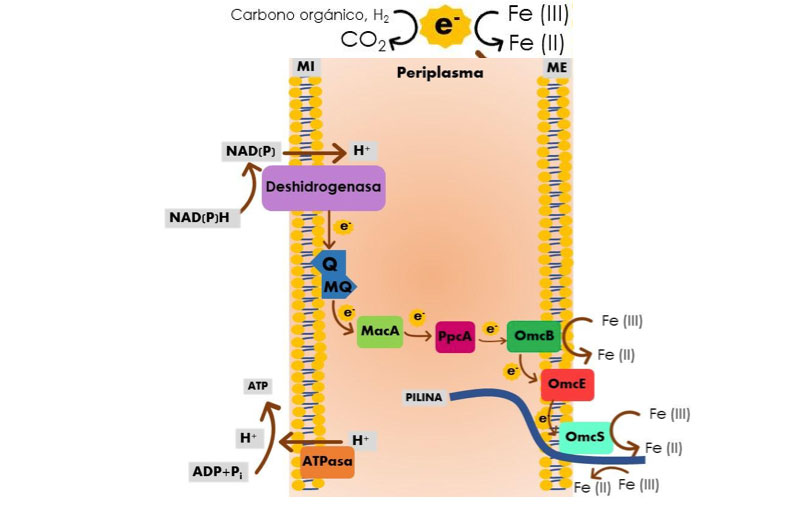
Tras su estudio, la respiración de Fe3+ inspiró biotecnologías: en un mecanismo que involucre a un aceptor de electrones, reemplazándolo por un material conductor o electrodo, los electrones pueden ser transferidos por los microorganismos hasta el electrodo durante la respiración de Fe3+ generando energía eléctrica ¿Se lo imagina? ¡El aparato electrónico que está utilizando ahora mismo podría ser alimentado por energía producida a partir de estos microorganismos!
Asociados con la respiración anaerobia, como la del Fe3+, se establece una notable variedad de relaciones sintróficas. ¡Sintrofía! Sí, sucede cuando, por ejemplo, la respiradora de Fe3+, Geobacter (Fig. 1b) cede electrones a la quimioorganotrofa Desulfobulbus (Fig. 1a). Por otro lado, los respiradores de Fe3+ también son capaces de aprovechar los productos de otros, p.e., el lactato o acetato generado por fermentadores (Fig. 3). Otro aspecto sintrófica y evolutivamente importante de la respiración de Fe3+ que no queremos omitir, es su participación en la reducción o respiración de otros elementos como cloritos, carbono orgánico y nitratos, en la que actúa como cofactor, como se muestra en la Figura 3. El hecho de que el Fe3+ esté involucrado en relaciones sintróficas como las mencionadas, nos permite comprender lo esencial de esta respiración en el ciclo del hierro en el planeta y su participación en otros ciclos biogeoquímicos, aún en lugares “inhóspitos” o extremos donde se podría creer que no hay vida debido a las condiciones que los caracterizan, pero…, ¡vaya! ¡Sí que la hay! C2
Bibliografía
Goldford JE, Hartman H, Smith TF, Segrè D. 2017. Remnants of an ancient metabolism without phosphate. Cell, 168:1126-1134
De Gregoris TB, Barroeta B, Esteve-Nuñez A. 2015. La columna bioelectrogénica. Revista Eureka sobre Enseñanza y Divulgación de las Ciencias, Universidad de Cádiz, 12:529-535
Hafenbradl D, Keller M, Dirmeier R, Rachel R, Roßnagel P, Burggraf S, Huber H, Stetter KO. 1996. Ferroglobus placidus gen. nov., sp. nov., a novel hyperthermophilic archaeum. Arch Microbiol, 166:308-314
Hernández G., Sánchez M. (2017). La plurifuncionalidad de las bacterias electrogénicas. Universitarios Potosinos, 211, 4-10
Stanley W, Southam G. 2018. The effect of gram-positive (Desulfosporosinus orientis) and gram-negative (Desulfovibrio desulfuricans) sulfate-reducing bacteria on iron sulfide mineral precipitation. Can J Microbiol, 64:629-637