A hustle here and a hustle there
New York City is the place where they said:
Hey babe, take a walk on the wild side
I said hey Joe, take a walk on the wild side
(https://www.youtube.com/watch?v=oG6fayQBm9w)
Lou Reed
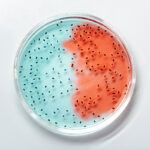
Quienes hacemos Microbiología o Biofísica sabemos que sistemas biológicos como las comunidades microbianas en biopelículas o biofilms, se caracterizan con palabras asociadas al concepto mismo de “sistema”. Complejo, dinámico, espacio-temporal, estructurado, funcional, heterogéneo y, las que destacamos “tiro por viaje”, interconexiones, interacciones y … ¿charlas?, ¿acuerdos? Será que sí porque al escuchar estos sistemas microbianos o biofilms, clarito se oye “hustle here, hustle there” (www.revistac2.com/bacteriele-muziek) y sugerencias tales como “hey Joe, take a walk on the wild side”. Será que sí porque sabemos que todas las interacciones y “acuerdos” en biofilms microbianos tienen enooormes implicaciones para la vida en la Tierra. Desde su origen hasta el arribo de … ¡de Lou Reed! De hecho, en esta escala de la vida las innovaciones biológicas que desataron procesos macroevolutivos sucedieron debido a las redes de interacciones que, no hay de otra, se facilitan en cercanía: dentro de biofilms.

Los biofilms son sistemas autónomos en cuyo interior suceden procesos orgánicos y biológicos a través de una gama de condiciones ambientales vinculadas a la composición y estructura de la comunidad, ambas cambiantes; comunidad que, dicho sea de paso, resume individualidades estrechamente vinculadas para la “conquista de la vida” (sobrevivencia), interactuando. Entre los procesos biológicos resumiremos algunos de los necesarios para formar una biofilm y que se asocian con el comportamiento de las células y las interpretaciones que hacen del ambiente: detección, señalización, transducción, motilidad, contacto, adhesión, comportamiento social, ¡cooperación! En casi todos estos participan unas estructuras extracelulares llamadas pili, ya descritas en un artículo de C2 (https://www.revistac2.com/las-bacterias-tambien-corren/).
Shaved her legs and then he was a she
She said, hey babe, take a walk on the wild side
Los pili pertenecen una superfamilia de Filamentos, específicamente escribiremos sobre los de tipo IV (T4F), que se ha diversificado en sistemas involucrados en la señalización, transducción de señales, la detección de superficies, adhesión a superficies, secreción de proteínas, absorción de DNA y en la motilidad tipo twitching… ese tipo de movimiento que hacemos cuando queremos caber donde ya no hay espacio en el transporte público. La filogenia de pili T4F sugiere que estaban ya presentes en el último ancestro común universal (ca. 4.3 mil millones de años), pues Bacteria y Archaea poseen sistemas T4F. Es decir, parece que, en efecto, ¡la elección, la sensibilidad, la comunicación, ya estaban exquisitamente desarrolladas en células microbianas! desde su origen, como lo sugiere J. Mitteldorf (2012).
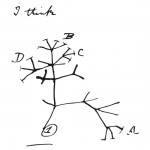
El ejemplar de T4F que nos interesa es de la subfamilia “a”, el “pilus tipo IVa” (T4aP; Fig. 2) e interesa por estar presentes en dos bacterias que habitan en ambientes disimiles pero que lo usan para más o menos lo mismo: Pseudomonas aeruginosa, cuyo T4aP ha sido ampliamente estudiado, y la bacteria objeto de nuestros estudios, Acidithiobacillus thiooxidans. Cierta información sobre la biología de ambas bacterias se resume en el Cuadro 1; sin embargo, destacaremos que P. aeruginosa es neutrófila (pH ca. 7.0) mientras que A. thiooxidans pareciera que vive cerca del infierno, es decir en ambientes ricos en minerales de azufre, altamente protonados y, mejor aún, a pH entre 2.0 y 1.5.
Pues bien, en ambas bacterias (Cuadro 1) la fibra del pilus T4aP está compuesta por una pilina mayor (PilA) que representando al “tronco” del pilus, y un complejo proteico de las denominadas “pilinas menores” que, mucho ojo, están en la punta de cada pilus (Fig. 2): FimU, PilV, PilW, PilX y PilY1, esta última una “adhesina” (Figs. 2a y 3). Las pilinas mayor y menores están relacionadas evolutivamente y tienen una estructura terciaria similar (excepto PlY1) que recuerdan una paleta “tutsi-pop” (lollipop; Fig. 3).
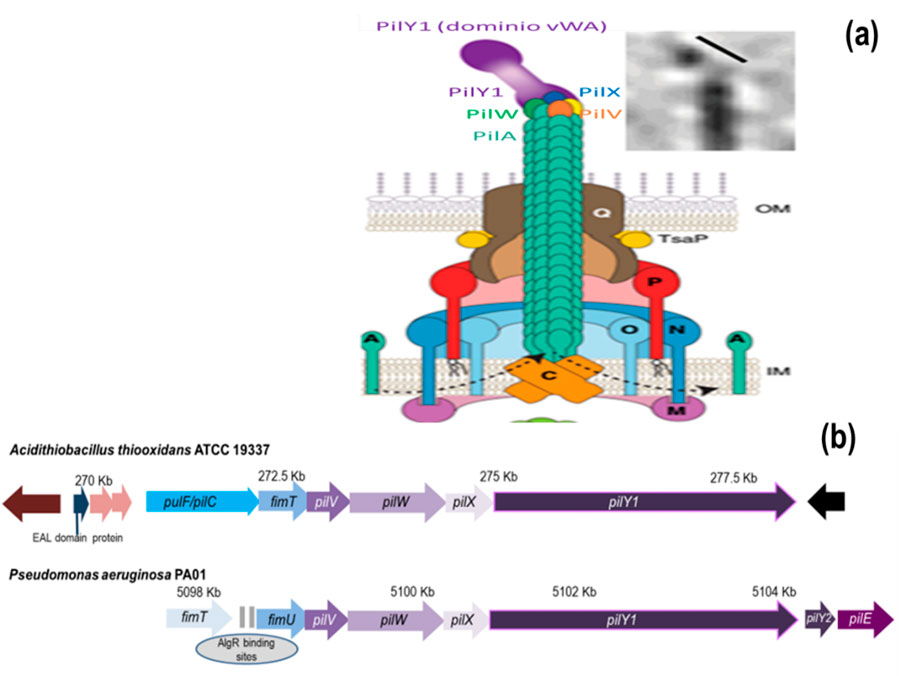
Los pili poseen propiedades elásticas, son reversibles: como pueden estar presentes y alargarse (polimerización de la PilA), pueden acortarse e incluso “retirarse” (despolimerización), saliendo y entrando alineaditos a través de otros complejos de pilinas: PilQ (de secreción) y PilMNOP (alineamiento) (Fig. 2a). Se sabe que la maquinaria para que sucedan tales eventos requiere energía tanto en la polimerización como en la despolimerización (PilB y PilT, respectivamente); es decir, son un comportamiento, “decisiones” con costo energético, que es mucho decir en sistemas biológicos y que da cuenta de lo “poderosa” que es la maquinaria molecular asociada a cada pilus.
But she never lost her head
Even when she was giving head
She says, hey baby, take a walk on the wild side
Sin pilinas menores no hay pilus que se forme, pues son el complejo de “iniciación” que proporcionar la plantilla para el ensamblado de PilA. Tan significativo como ello es su ubicación, sí, así es: estar en la punta es establecer el primer contacto con la superficie y con diversas señales extracelulares (físicas, químicas y mecánicas). He aquí su importancia para las funciones de los pili ¿en? Recordemos: señalización, transducción de señales, detección y adhesión a superficies, que es de lo que desea comentar ahora mismo, pues cada biofilm se formará cuando se opte por una superficie aceptable (orgánica o inorgánica), y ¿cómo decidir la “mejor” opción? Conociéndola gracias a lo que está en la punta del pili, el complejo proteico que forman las pilinas “menores” y su inseparable adhesina PilY1, FimUPilVWXY1.
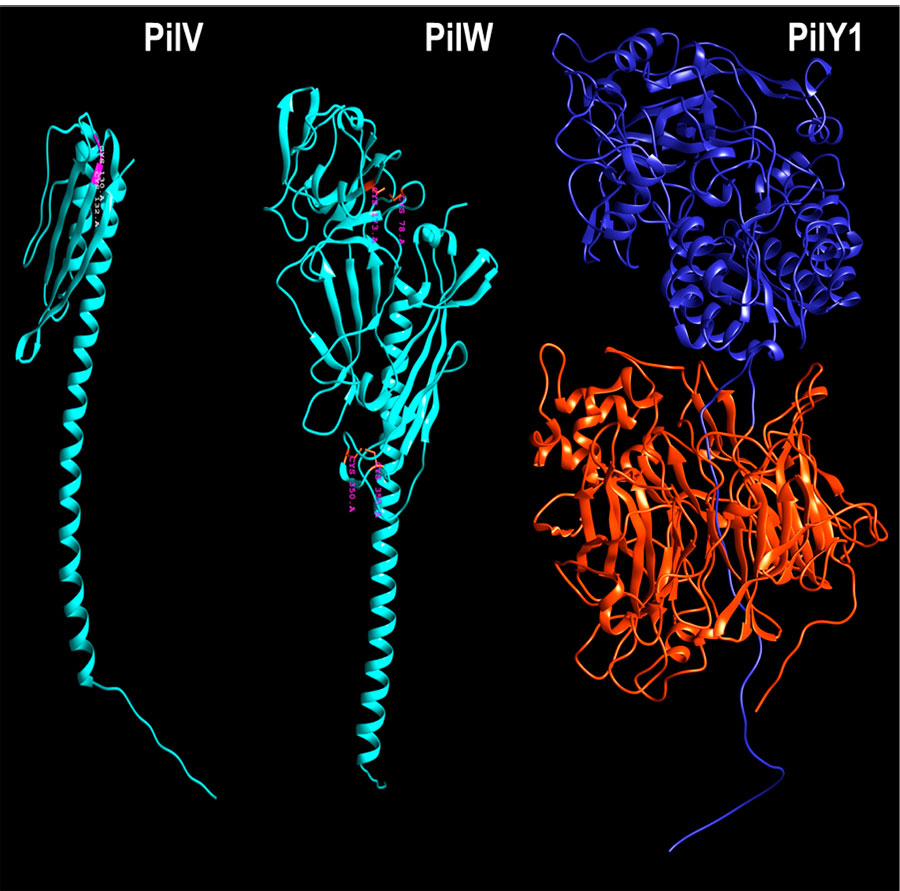
Se propone que la decisión se desata debido al sentido del tacto, sentido de las fuerzas mecánicas ante superficies y la hidrodinámica del entorno (¡mecanosensibilidad!). La mecanodetección de una fuerza es transmitida como cambios conformacionales en pilinas y traducida (¡mecanotransducción!) a cambios conformacionales para la incorporación/desincorporación de PilA, que durante la formación del pili empuja al complejo de pilinas menores de la punta, FimUPilVWXY1. Ahí en la punta, si se observa nuevamente la Figura 2a, está ¡PilY1 en la punta de la punta! Pues bien, PilY1 contiene un mecanosensor, el “dominio A del factor von Willebrand” (vWA) que, además tiene dos cisteínas, aminoácidos con S (azufre pues), formando un puente disulfuro ¡S-S en la punta de la punta de la punta! Bueno, sobre este vWA de PilY1 vale la pena comentar que es un dominio superconservado a lo largo de la historia evolutiva, desde bacterias hasta la especie Homo sapiens, especie a la que pertenece Lou Reed
Regresando al puente disulfuro S-S en la punta de la punta de la punta del pilus, se estima que los cambios en el estado óxido-reducción de S-S provocan el plegamiento, estiramiento, o replegamiento, no del pilus, sino de la mismita PilY1 en la punta de la punta!, eventos mecánicos que se comunican a lo largo (o corto) del pilus. Se ha observado que es posible ajustar tal estado redox en S-S usando fuerzas mecánicas, lo que indica que éste es un mecanismo que las bacterias usan para detectar el contacto con la superficie hasta que el enlace S-S se rompe, con PilY1 anclado a la superficie (Webster et al. 2022): ¡comienza la retracción del pili! provocando un contacto menos tenso con la superficie, manteniéndose la adhesina PilY1 en la superficie de membrana externa, pero solita… sin el resto de las pilinas.
Al proceso de decisión sobre la superficie a colonizar para la formación de un biofilm, se suman un sistema quimiosensor, dual, de “transducción de señales y reguladores de respuesta” o S/R u otros, como el que indica cuándo comenzar la despolimerización de un pilus; interviene, además, el doble enlace S-S relajado en la punta de la punta del pili (de la adhesina PilY1) que induce a la formación del biofilm. Lo descrito puede aplicarse para P. aerugionosa y otros neutrófilos (Cuadro 1), pero ¿y en acidófilos como A. thiooxidans? La pregunta no es trivial, pues el enlace S-S puede debilitarse significativamente por la presencia de un ácido (o base) de Lewis.
Valium would have helped that bash
She said, hey babe, take a walk on the wild side
Además poder detectar superficies a través de pili, controlando su tensión, las bacterias responden a la deformación de la membrana celular inducida por la superficie, así como a la quimiodetección de, por ejemplo, cambios locales de pH y de ciertos iones o (bio)moléculas específicas, incluyendo las que liberan las superficies con las que interactúan. Por supuesto, estas señales deben ser interpretadas para responder en consecuencia. La quimiodetección requiere (1) “quimioseñal” o un compuesto químico, (2) quimiorreceptor ad hoc, (3) quimiotransductor y muy especialmente, (4) una densidad crítica de células con las cuales charlar para que el mensaje recibido y el comportamiento ocurra de manera sincronizada como para ¡formar un biofilm! Esto último ha sido evidenciado en diversos ensayos de, por ejemplo, bacterias fluorescentes que solo pueden producir biofluorescencia si hay cierto número de células que “digan” algo así como “y la luz se hizo”. El concepto detrás de este comportamiento se denomina Quorum Sensing (QS), ya que desata un comportamiento social, colectivo, de “construyamos un biofilm” o “que se haga la luz”.
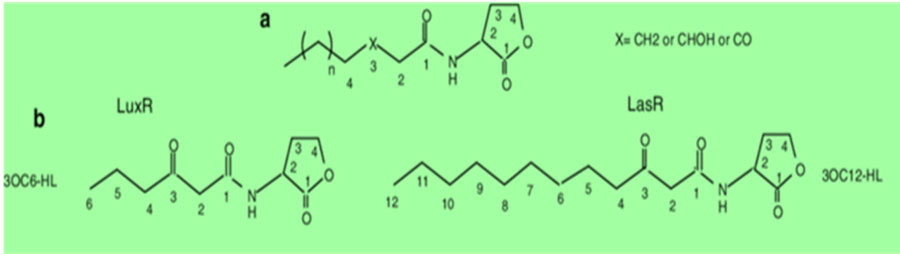
Si rastreamos el tipo de moléculas que interviene en el QS para la formación del biofilm, se puede usted llevar una agradable sorpresa. Veamos la llamada N-acil homoserina-lactona (o AHL para los cuates) presente en muchas especies de bacterias regulando, entre otras respuestas, la producción de polisacáridos extracelulares, componente principal de la matriz extracelular de biofilms. La AHL posee una estructura general básica (Fig. 4a) con una misteriosa “R” que representa una cadena de carbonos más o menos larga, según la especie de bacteria. Es decir, la R de la AHL cambia en cada especie bacteriana. Por ejemplo en A. ferrooxidans, “prima” de A. thiooxidans (Cuadro 1), R posee de 12 a 14 átomos de carbono, como lo demostraron los grupos de los investigadores chilenos, Nicolás Guilliani y Cecilia Demergasso en 2013. Por su parte, en P. aeruginosa intervienen tres tipos de AHL, todas con su R de diferente número de átomos de carbono, una de las cuales solo posee 5 (LuxI). Se sabe que el tamaño de R determina si el lenguaje puede ser comprendido por una u otra especie bacteriana ¡bilingüe! ¿o multilingüe?
I said, hey honey, take a walk on the wild side
And the colored girls say
Doo doo doo doo doo doo doo doo doo
Hemos descrito señales mecánicas y químicas que son leídas e interpretadas por proteínas (pilinas) y bacterias (QS); de igual manera que las enzimas deben enviar señales al DNA para que éste “responda” y sea posible el desempeño fisiológico de cada ser vivo en su entorno. Así se comienza la formación de un biofilm, respondiendo a señales.
Ya asentadas sobre la superficie o no, biótica o no, las bacterias se “multiplican” por reproducción o por la llegada de nuevos individuos gracias, o no, al QS. Algunas bacterias serán de la misma especie, ¡o no! De no ser de la misma especie, el biofilm será una auténtica comuna de diversas especies con diferentes capacidades metabólicas, maximizando el uso y la transformación de materia y energía: lo que para unas es un producto de “desecho” para otra es una fuente de nutrientes, elementos o electrones. Haciendo uso eficiente del bien común (p.e. tu desecho es mi alimento y mi tesoro), se puede proseguir. Doo doo doo doo doo doo doo doo doo.
Coordinándose ayudadas de los pili para interconectarse y dar cierto andamiaje al biofilm, las células se reorganizarán gozando del mentado twitching, “hustle here, hustle there”, Ya acomodaditas y con las señales comprendidas, cada célula comienza a producir y secretar desde su interior sustancias poliméricas extracelulares (EPS) para construir ¡el barrio donde habitarán, todas, barrio que “is the place where they said: Hey babe, take a walk on the wild side”. Barrio que brinda soporte y protección, es un “almacén” de nutrientes, un enramado con canales por donde navegarán compuestos más o menos hidrosolubles, gases, iones, … Así, se aplica la típica frase de “mi barrio me respalda”.
Regresan los pili a escena: recordará usted que la retracción del pili induce un contacto menos tenso entre la adhesina PilY1 (localizada en la punta de la punta de cada pilus) y la superficie; también recordará que PilY1 permanece en la superficie de membrana externa, solita, sin el resto de las pilinas. Pues bien, la presencia de PilY1 en membrana externa activa otra quimioseñal cuyo “quimiorreceptor” estimula la producción de EPS y, por lo tanto, la formación del biofilm. Además, ¡hey honey!, los polisacáridos extracelulares, un auténtico moco dulce, ayudan al biofilm a mantenerse bien pegadito en la superficie mientras que la mencionada adhesina PilY1 participa en este “pagamiento” que asegura la estabilidad del biofilm. Un biofilm fuertemente adherido, difícil de quitar, es harto problemático en ambientes hospitalarios, pero es la respuesta deseable y una buena manera de subsistir en ambientes menos críticos, más benevolentemente naturales.
Dependiendo del tipo de biofilm, se consiguen establecer microambientes; por ejemplo, uno que contenga regiones aerobias, anaerobias y, entre una y otra, “intermedias” con mayor o menor concentración de oxígeno. Por supuesto que así incrementa la diversidad de, en este caso, tipos de respiración o, dicho de otra manera, “dota de coloridos estilos de oxidar comida” dentro del biofilm (Fig. 1). ¿Importancia de ello? Básicamente eso que se dijo previamente sobre el que, dentro del biofilm se hace un uso más provechoso de materia y energía al integrarse distintas maneras de, justamente, aprovecharlas (rutas metabólicas). Además, dentro de biofilms la trasferencia de genes es viable, más efectiva. Y captar uno que otro gen que se añada a la dotación genética de cada individuo es mucha ganancia para, nuevamente, el bien común.
Esta asociación con diferentes bacterias y capacidades metabólicas dentro de un biofilm, supraindividual, solo pueden ser benéfica; de lo contario ¿para qué tanto gasto energético y uso de recursos en formarlo? Ya lo decía Lynn Margulis más o menos así: la vida en común, cual si pacto simbiótico y red de seguridad y bienestar, también evidencia que la vida se “conquista” no combatiendo sino interactuando y sumando para mantener el bien común. En fin, ésta es la vida dentro del biofilm… ajena al dogma del “gen egoísta”. C2
Doo doo doo doo doo doo doo doo doo 











Victoria Glz -
Siempre me han interesado los biofilms pero jamás había dimensionado la interacción de sus habitantes. Gracias por la recomendación musical tan bien relacionada.
ANAHI RODRIGUEZ -
Wow!! Amazing information