Hablar de átomos y moléculas hoy en día es tan común como hablar de células o de casas o de aviones.
A principios del siglo XX, la existencia de dichos entes estaba todavía en discusión.
Son parte de nuestro entorno y todos creemos o aceptamos que todo lo que nos rodea está hecho de átomos y moléculas, a pesar de que no podemos verlos. Cuesta trabajo creer que apenas hace 100 años, a principios del siglo XX, la existencia de dichos entes estaba todavía en discusión. No era por razones filosóficas o profundas de la ciencia, era simplemente motivo de debate debido a que no existían pruebas experimentales tangibles, que se consideraran irrebatibles y que demostraran que efectivamente todo está hecho de átomos y moléculas. El joven Albert Einstein, en 1905, al mismo tiempo que desarrolló la teoría especial de la relatividad y explicó el efecto fotoeléctrico que a la postre le daría el premio Nobel, ese año, que se le ha llamado año maravilloso, diseñó la posibilidad de realizar un experimento que diera luz sobre la existencia de los átomos. Como comúnmente ocurre con los trabajos científicos, el título de dicha obra difícilmente refleja la profundidad y trascendencia de su contenido: “Sobre el movimiento de pequeñas partículas suspendidas como lo requiere la teoría cinética del calor” [1], publicado en la revista alemana Annalen der Physik, volumen 17, página 549, año 1905.
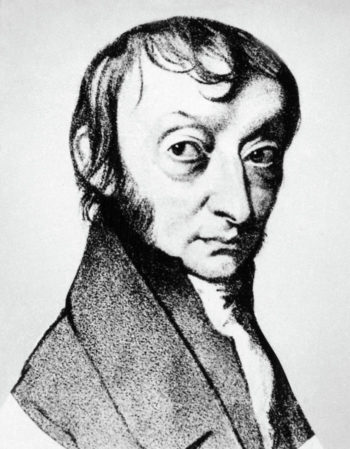
Para darnos una idea de cómo Einstein abordó el problema y entender que lo llevó a esa conclusión, remontémonos no al principio del siglo XX, sino al principio del XIX. Científicos de aquella época, como el inglés John Dalton y el francés Joseph Gay-Lussac, entre otros, ya vislumbraban que la materia parecía tener raíces atómicas, debido a que las reacciones químicas indicaban que debían darse en términos de proporciones enteras de sus componentes. Por ejemplo, sabían que para obtener agua (H2O) debían combinarse 2 partes de hidrógeno (H) con una parte de oxígeno (O). Esto sugería que debía llegarse a un límite donde sólo hubiera una unidad, o átomo, de oxígeno, combinándose con 2 átomos de hidrógeno, para formar una sola molécula de agua. Por la misma época se llegó a la conclusión que un gramo de gas de hidrógeno ocupaba el mismo volumen que 8 gramos de oxígeno. Así, un personaje importante en esta historia, el italiano Amedeo Avogadro, enunciaba que, a presiones y temperaturas iguales, iguales volúmenes contenían el mismo número de átomos (o moléculas). Una conclusión era que, como se sabía de mediciones experimentales, dado que el oxígeno es 8 veces más pesado que el hidrógeno, entonces, en 8 gramos de oxígeno debería haber el mismo número de átomos que en 1 gramo de hidrógeno. A ese número ahora lo conocemos como el Número de Avogadro, o mol, que es igual a la fantástica, enorme cantidad de 6 X 1023 aproximadamente (un 6 con 23 ceros). Esto último no lo sabían en el siglo XIX, es conocimiento del XX, pero fue parte importante en el debate de la existencia de los átomos. Regresaremos a este punto más adelante.
A mediados del siglo XIX, se sentaron las bases de lo que ahora llamamos la teoría de la termodinámica.
Cincuenta años después, a mediados del siglo XIX, se sentaron las bases de lo que ahora llamamos la teoría de la termodinámica, notoriamente con los trabajos del alemán Rudolf Clausius. La termodinámica no hace referencia a los átomos, pero sí a una cantidad difícil de discernir que llamamos calor. Casi de inmediato a los trabajos de Clausius, y de otros antes de él, el escocés James Clerck Maxwell y el austriaco Ludwig Boltzmann, se dieron a la tarea de explicar “eso que llamamos calor”, así como a la temperatura, la entropía y otras cantidades de la termodinámica, en términos del movimiento incesante e insensato de los átomos. Aunque ahora lo vemos como algo “natural”, en su momento no fue así. Se generó una apasionada lucha intelectual entre los “atomistas” y sus detractores, que no terminó sino hasta principios del siglo XX. Como ya mencionamos antes, los detractores no se oponían por terquedad, sino porque no había una evidencia directa de la presencia de esos “objetos”. La hipótesis atómica, decían, es tan sólo una buena “herramienta” para explicar de manera indirecta el resultado de estudios experimentales, pero argüían que carecía de sustento.

De manera totalmente independiente, en 1827, el botánico inglés Robert Brown observó con su rudimentario microscopio que partículas de polen, suspendidas en agua, mostraban un movimiento ininterrumpido y errático. Lo primero que se le ocurrió era que estaba observando un fenómeno biológico, quizás la vis viva, la buscada fuerza vital. Pero no, Brown era un buen científico y experimentó con toda clase de partículas, cenizas, roca pulverizada, y con todas observó lo mismo, ese movimiento incesante. Se dice que hasta consiguió polvo de la Esfinge para mostrar que el movimiento no tenía nada que ver con algún fenómeno biológico: “algo inexplicable” hacía que las partículas se movieran de esa forma. A dicho fenómeno se le conoció después y hasta nuestros días como Movimiento Browniano, en su honor, y su explicación como veremos la hizo Einstein, forma parte de nuestra ciencia actual y ha permeado a muy diversas áreas de investigación. Aún así, desde esa época, algunos científicos pensaron que el movimiento de la partícula “Browniana”, observable en el microscopio, era consecuencia de las múltiples colisiones que ésta sufría con los átomos del fluido. Sin embargo, esos esfuerzos fallaron en proveer una explicación irrefutable. Esa explicación fue lo que logró el joven Einstein y mucho más.
¿Cuántos átomos hay, por ejemplo, en una gotita de agua?
Albert Einstein era un atomista. Ya para su época, a principios del siglo XX, a la teoría de Maxwell y Boltzmann se le llamaba la “teoría cinética del calor” y su base era, sin duda, que la materia estaba compuesta por átomos y que las regularidades que observamos a nuestro nivel “macroscópico” está determinado por lo que ocurre entre los átomos a nivel “microscópico”. Einstein estaba tan familiarizado con esos conceptos que, entre 1902 y 1903, en unos trabajos que son poco conocidos, sentó las bases de la teoría que ahora se llama Física Estadística y que, usualmente, su creación se le atribuye al estadunidense Joshua W. Gibbs. Pero había muchos problemas por entender y había que idear un experimento que diera lugar a la buscada prueba irrefutable. Entre muchas preguntas, hay un par importantes que deben contestarse, una es ¿de qué tamaño son los átomos y por qué no los podemos ver? y la otra, ¿cuántos átomos hay, por ejemplo, en una gotita de agua?. La primera tuvo que esperar unos años más, con los trabajos del danés Niels Bohr, pero la segunda sí fue contestada gracias a su trabajo. Y como seguimos insistiendo, logró mucho más.

Einstein inicia con imaginarse una situación experimental y en buscarle la respuesta. Este procedimiento célebre de Einstein, llamado gedanken experiment en alemán, es la marca de un genio: podía imaginarse de manera correcta el resultado de un experimento, sin realizarlo. Einstein pensó en lo siguiente: imagínense una pelota (del tamaño de una pelota de golf, por ejemplo) sumergida en un líquido como el agua. Supongamos que el agua está estática y que no tiene corrientes ni flujos. En tal situación, la pelota no se movería tampoco, se quedaría estática. Ahora imaginemos que la pelota se empieza a hacer más y más pequeña: ¿seguirá estática? Si no hay átomos, entonces el fluido seguiría siendo fluido sin importar que pequeña fuera la pelota. Sin embargo, Einstein siendo un atomista, nos afirma que el fluido está compuesto por átomos y que llegaría un momento en el que la pelota fuera lo suficientemente pequeña, tal que ahora sí sintiera los golpeteos casi individuales de dichos átomos. Y Einstein concluye que, como consecuencia de esos golpeteos dispares, la pelota empezaría a sentir empujones de diferente fuerza en diferentes direcciones y que, por lo tanto, empezaría a moverse de forma errática o zigzagueante. Al mismo tiempo señala que si tal movimiento no se observara, entonces la teoría del calor, basada en los átomos, sería incorrecta. Einstein abre la posibilidad de que, efectivamente ¡los átomos no existan! Es muy curioso e interesante señalar que Einstein menciona que probablemente ese movimiento que él se imagina sería similar al observado por Brown, pero dice que no puede concluir que así sea debido a la falta de datos precisos. Otra marca de un gran científico: sin datos experimentales confiables, no se puede hacer una afirmación científica. Dicho sea de paso, esto no siempre es respetado, aún en nuestros sofisticados tiempos
Pero Einstein se aferra a su teoría y, primero, en un lance atrevido conecta lo microscópico con lo macroscópico. Para esto hagamos un breve paréntesis. Existe un fenómeno muy común llamado difusión. Este es el que ocurre cuando ponemos un fluido en contacto con otro. Por ejemplo, cuando le ponemos, con cuidado, leche al café (con agua): de manera suave y lenta la leche se empieza a mezclar con el café. Decimos que la leche se difunde en el agua. De la misma manera, si ya aceptamos que una pelotita se empezaría a mover en el agua por el golpeteo con los átomos, entonces, si pusiéramos muchas juntas en el agua, por dichos golpeteos, el conjunto de las partículas empezaría a difundirse lentamente en el agua. Einstein conectó, usando una fórmula matemática que él dedujo, tal difusión con la temperatura y viscosidad del agua, propiedades “macroscópicas”, con el número de Avogadro de átomos y con el tamaño microscópico de las pelotitas zigzagueantes o Brownianas (ya mejor las llamamos así). Y después, en un dechado de genialidad, Einstein conecta tal difusión con la distancia (en promedio) que las pelotitas se moverían en un segundo. Esta es la parte más novedosa y genial de su trabajo pues inventa lo que ahora llamamos la teoría de los procesos estocásticos (o azarosos). Se adelanta al ruso Andreiv Markov y de manera independiente al polaco Marian Smoluchowski, en el uso de la teoría para describir cómo se mueven en promedio partículas erráticas o azarosas. Este avance ha trascendido profundamente en prácticamente todos los campos del conocimiento; regresaremos a este logro más adelante.
Einstein finalmente hace una predicción que puede corroborarse en un experimento.
Conjuntando los resultados anteriores, Einstein finalmente hace una predicción que puede corroborarse en un experimento: predice que una partícula, suspendida en el agua y del tamaño de una micra (la millonésima parte de un metro), como las que pueden observarse con un microscopio, se movería en promedio 6 micras en un minuto. Así de simple. Es cosa de hacer un experimento y medir muchas veces la distancia que una partícula Browniana en el agua se mueve en un intervalo de un minuto, luego promediar tales distancias y comparar con la predicción. Es emotivo leer en el artículo original de Einstein que lo culmina, con mucha emoción, diciendo que es “urgente que algún investigador haga el experimento … ¡pues es de gran importancia para la teoría del calor!” … es decir, para corroborar la existencia de los átomos.
El trabajo sobre el movimiento Browniano fue un éxito inmediato.
A diferencia de los otros trabajos de Einstein de ese año 1905, que fueron recibidos con escepticismo, este trabajo sobre el movimiento Browniano fue un éxito inmediato. Más allá de que indicaba un experimento cuantitativo sobre la existencia de los átomos (que no era un logro pequeño), los conceptos eran completamente clásicos, es decir no apelaban a nada “nuevo” o “revolucionario”, como si lo eran la relatividad especial o el afirmar que la luz no era una onda sino un conjunto de corpúsculos, llamados fotones ahora. Así, un científico francés Jean Perrin, se dio a la tarea de realizar precisamente el experimento diseñado por Einstein y en 1909 publicó sus resultados, demostrando todo lo predicho. Y aún más, pudo inferir el número de Avogadro obteniendo 7 X 1023, muy cercano al valor aceptado actualmente. Quedaron ya muy pocos escépticos, los átomos eran, o son, reales. Por cierto, por ese estudio, Perrin recibió el premio Nobel en 1926.
Concluimos este escrito con dos detalles. El primero es el hecho que Einstein hizo uso de la probabilidad y la estadística, de manera original e independiente a otros investigadores, iniciando en la física una forma de abordar problemas complejos. Esa forma de analizar los procesos estocásticos es de gran poder en la actualidad y ha permeado a todos los campos del conocimiento, desde la física, la química la biología, ingeniería, hasta las ciencias sociales y las finanzas. Un legado más de ese increíble joven. El otro aspecto es el vislumbrar por qué fue y es tan difícil entender qué son los átomos. Aparte de su carácter cuántico, que esa es otra historia para otro escrito, lo que los hace complicados de “sentir” es que, primero, son pequeñísimos y, segundo, que ¡son muchísimos!
El tamaño de los átomos es aproximadamente 10-10 de un metro.
Después del trabajo de Bohr en 1911, sabemos que el tamaño de los átomos es aproximadamente 10-10 de un metro. Es decir, divida un metro en mil pedacitos iguales, eso es un milímetro, que lo vemos en una regla; luego divida ese milímetro en mil partes más, eso es una micra (o micrómetro), la millonésima parte de un metro. Nuestros ojos, con ayuda de un microscopio óptico como el que usaba Brown, pueden ver hasta esa pequeñez. ¡Más pequeño que una micra ya no podemos ver! Es una limitante física de nuestros ojos, y esa es también otra historia a contar. Bueno, ahora tome esa micra y divídala en diez mil partes, de ese tamaño son los átomos. Es inimaginable ese pequeño tamaño y, ni modo, nuestros ojos jamás verán un átomo. Pero nos preguntamos, ¿si la materia está granulada, por qué no la percibimos así? el aire, el agua, cualquier objeto sólido, se siente continuo, lisito, sin ninguna granulación. Y aquí entra el número de Avogadro. Con esa información podemos concluir, por ejemplo, que en una gota de agua hay aproximadamente 1021 moléculas de agua, ¡un 1 seguido de 21 ceros!, que es, más o menos, el número de estrellas que hay en todo el universo! No somos nada. C2
Referencias
[1] Traducción libre del título en inglés, a su vez traducido del alemán, idioma en el que se publicó originalmente.





Sabah -
Increíble las explicaciones, las referencias de los trabajos anteriores y la descripción cronológica de los eventos, es la historia narrada en un artículo. Muchas gracias.
Héctor Alva -
¡Excelente y muy claro!