El ácido fórmico al descubierto: historia, propiedades y curiosidades
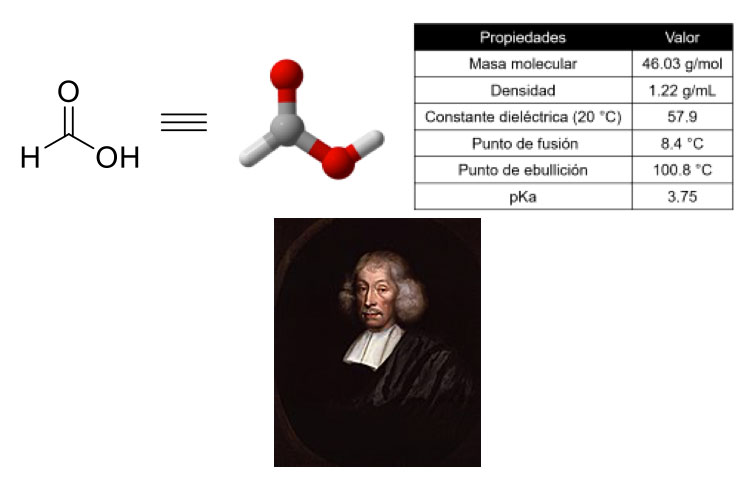
El ácido fórmico es el ácido orgánico más sencillo que existe (figura 1). Su nombre se deriva de la palabra latina formica, debido a que se encontró por primera vez en las hormigas rojas (formica rufa). En 1670, el naturalista John Ray aisló por primera vez el ácido fórmico al destilar directamente a hormigas machacadas [1]. Otros insectos (como cierto tipo de abejas) también producen ácido fórmico, ya que muchos de ellos lo utilizan como un mecanismo de defensa [2]; en consecuencia, también se encuentra en pequeñas cantidades en la miel de las abejas [3]. Es interesante el hecho de que, en el contexto de las investigaciones sobre el origen de la vida, se haya propuesto que la singular molécula fue producida en nuestro planeta desde tiempos ancestrales en las ventilas hidrotermales del lecho marino, a través de la reacción de moléculas elementales como el dióxido de carbono (CO2) y agua (H2O) [4]. Ahora bien, desde una perspectiva astronómica, se han encontrado evidencias de la presencia de ácido fórmico en la estela del cometa Hale Bopp [5].
El ácido fórmico es un líquido incoloro y de aroma pungente. Es corrosivo a los metales, pero puede almacenarse en contenedores de vidrio o plástico [6]. Por su estructura química, el ácido fórmico es muy soluble en agua y en algunos disolventes orgánicos polares como éter, acetona y alcoholes; aunque, también es parcialmente soluble en disolventes no polares como tolueno y benceno. La acidez del ácido fórmico es considerada como moderada. Es interesante que si bien su pariente más cercano, el ácido acético (componente principal del vinagre), presenta una pequeña diferencia que consiste en un átomo de carbono más (en forma de un grupo metilo), se ha estimado que la potencia del ácido fórmico es aproximadamente 10 veces mayor [7]. El ácido fórmico se congela a 8.4 °C y comienza a ebullir a 101 °C, y aunque es un material combustible, no es muy inflamable. Tiene la particularidad de ser considerado no tóxico y aceptable en términos ambientales [8]. En cuanto a su composición elemental, el ácido fórmico está formado por dos átomos de oxígeno, un carbono y dos átomos de hidrógeno, lo que corresponde a un 70%, 26% y 4% en masa, respectivamente.
Redefiniendo la síntesis del ácido fórmico: de métodos antiguos a alternativas sustentables
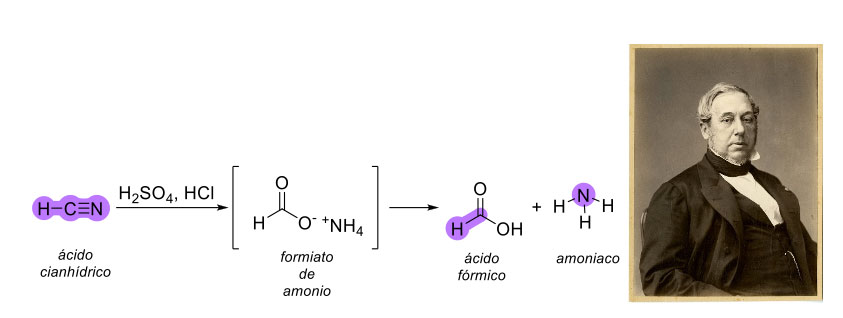
Como se mencionó anteriormente, el ácido fórmico se obtenía mediante la destilación de hormigas, pero fue hasta 1831 que el químico francés Jules Pelouze logró sintetizar el ácido fórmico por primera vez mientras estudiaba la reacción del ácido prúsico (ácido cianhídrico, HCN, figura 2), con ácido clorhídrico (HCl) y ácido sulfúrico (H2SO4) [9]. La reacción entre estos tres ácidos da lugar a la formación de formiato de amonio, que posteriormente se descompone en ácido fórmico y amoniaco.
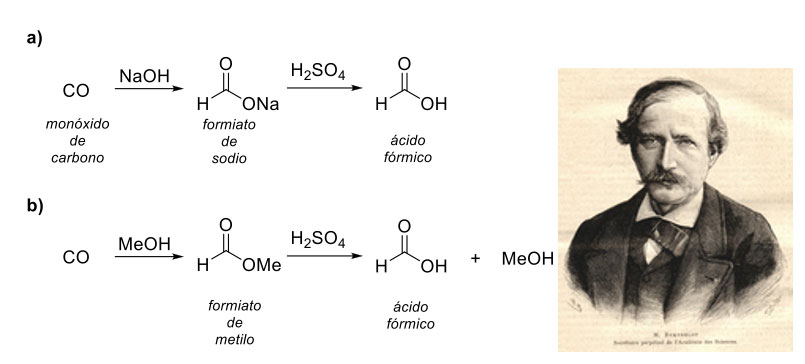
En 1855 el célebre químico francés, Marcellin Berthelot, consiguió sintetizar el alcohol etílico a partir de acetileno [10] y en 1856, a través de la exposición del monóxido de carbono (CO) a un medio alcalino, consiguió preparar el formiato de sodio (HCOONa). El cual, al ser expuesto a las condiciones fuertemente ácidas del ácido sulfúrico, daba como producto el ácido fórmico (figura 3a) [11]. El logro que representó la síntesis de estos compuestos de origen orgánico convenció a Berthelot de que la química podría destruir la creencia metafísica de una fuerza vital necesaria para la generación de compuestos orgánicos (vitalismo) y sentaron las bases para su ambicioso programa de “síntesis total” que tenía como objetivo la preparación metódica de todos los compuestos orgánicos, partiendo de sustratos inorgánicos u orgánicos sencillos. Es posible que la síntesis del ácido fórmico de Berthelot sirviera como inspiración para uno de los métodos más utilizados hoy en día para la síntesis de ácido fórmico (figura 3b), la cual consiste en hacer reaccionar monóxido de carbono con metanol (MeOH) para obtener formiato de metilo (HCOOMe), un paso posterior de hidrólisis ácida conduce al ácido fórmico [9b].
Aunque el uso de metanol en la producción de ácido fórmico es una opción relevante a nivel industrial, involucra desventajas importantes. El metanol es altamente tóxico, lo que requiere medidas de seguridad rigurosas. Además, su manejo y la necesidad de recuperarlo (para hacer el proceso redituable) agregan mayor complejidad. Además, el origen fósil del monóxido de carbono [12] plantea preocupaciones ambientales. El proceso de hidrólisis también demanda grandes cantidades de agua [13]. Este escenario ha impulsado la búsqueda de alternativas más sostenibles, conjuntando a la vez con la viabilidad económica. Por ejemplo, existe una síntesis de ácido fórmico a partir de glicerina, cuya producción principal es a partir de grasas naturales (glicéridos) [14]; sin embargo, la metodología involucra el uso de catalizadores basados en metales preciosos, como oro y paladio, lo cual hace de este tipo de procesos menos atractivos para la industria.
Las aplicaciones del ácido fórmico, que van desde la industria química y farmacéutica, y se extiende hacia el área energética, alimentación y remediación de aguas residuales, impulsan cada vez mejores estrategias para lograr la mayor eficiencia y sostenibilidad en la síntesis de este importante reactivo de plataforma. Tan solo en 2019, la producción global de ácido fórmico a escala industrial ascendía a 760 mil toneladas [15].
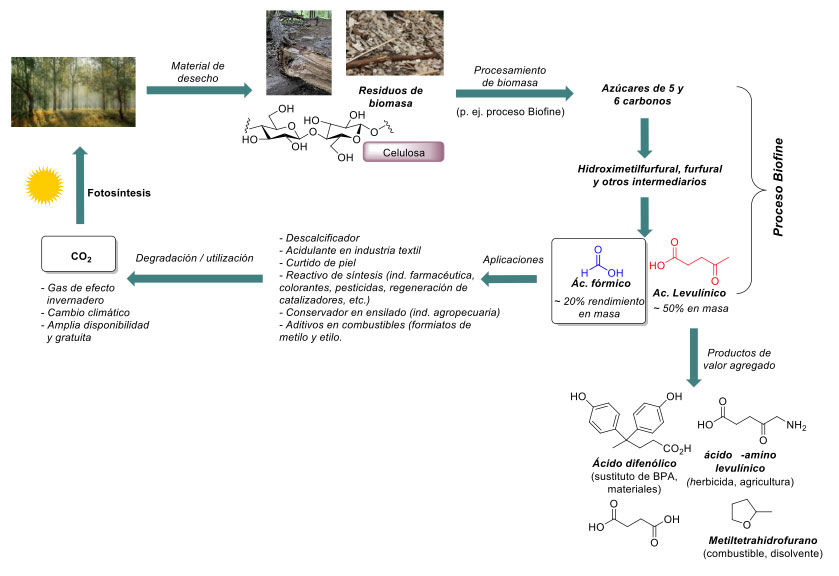
En el contexto de los desafíos ambientales a nivel mundial, donde el aumento en la concentración del dióxido de carbono (CO2) global en la atmósfera terrestre causa estragos climáticos y mantiene un ambiente de preocupación en distintos sectores, la ciencia y la industria están enfocadas en convertirlo en un recurso aprovechable. EL CO2 es un gas de efecto invernadero, así que la captura y aprovechamiento de este gas (valorización) [16], tendría un efecto dual al disminuir su concentración en la atmósfera y en paralelo servir como materia prima accesible y abundante. La biomasa, a través de la fotosíntesis, captura efectivamente al CO2 de la atmósfera para el crecimiento de las plantas. Cuando la biomasa se convierte en biocombustibles o en productos químicos, el carbono previamente capturado se regresa a la atmósfera cuando los combustibles son utilizados o las sustancias químicas son degradadas (figura 4). Con un diseño basado en sustentabilidad, el proceso arriba descrito puede ser carbono neutral (sin aumento neto de CO2) o inclusive carbono negativo (que captura más del CO2 que se libera) gracias a la regeneración de biomasa. Esta valorización indirecta de CO2 destaca el potencial de la producción de biomasa para tener un panorama más responsable y sostenible. Por ejemplo, el proceso Biofine es una tecnología que transforma la biomasa lignocelulósica, como los residuos agrícolas o madereros, en productos químicos de plataforma [17], [18] (p. ej. ácido levulínico y furfural). Esta tecnología es completamente química [19], y también da lugar a ácido fórmico en un rendimiento aproximado del 10% de la masa celulósica [17a].
Ácido fórmico: una alternativa sostenible para la generación de hidrógeno y producción de energía
Es innegable que una fuente importante de las emisiones de CO2 en el planeta es la quema de combustibles fósiles, por lo que la búsqueda de fuentes de energía alternativas se ha intensificado en épocas recientes. El hidrógeno ha surgido como una alternativa a los combustibles tradicionales, puesto que ofrece la capacidad de generar electricidad de manera eficiente con el mínimo impacto ambiental directo (cero emisiones de CO2, donde el producto de su combustión es agua). Sin embargo, la mayoría de la producción de hidrógeno se basa en fuentes fósiles, como por ejemplo el gas natural. El hidrógeno derivado de fuentes fósiles representó cerca del 80% de los 90 megatones de hidrógeno consumidos en 2020 [20]. Existen tecnologías que producen lo que se denomina “hidrógeno azul” que, aunque utilizan fuentes fósiles en su producción, evitan la liberación de CO2 a la atmósfera mediante su captura (entre un 85% y un 95% del CO2 es capturado). Sin embargo, se estima que la huella de carbono de estas tecnologías podría ser considerablemente mayor, oscilando entre un 20% y un 60%, en comparación con el uso directo de combustibles fósiles [21]. No cabe duda de que el empleo del hidrógeno como fuente de energía presenta desafíos significativos antes de que pueda considerarse, en un futuro cercano, una alternativa energética verdaderamente libre de emisiones.
El perfil verde de las tecnologías que aprovechan al hidrógeno como fuente de energía depende proporcionalmente de aquellas que lo producen. También es importante considerar que el transporte y almacenamiento de hidrógeno es costoso y de alto riesgo. Por ejemplo, para almacenar 1 kg de hidrógeno a condiciones normales [22], se requiere de un contenedor de casi 12 m3 de capacidad (12,000 litros), por lo que la presurización es esencial para el transporte. Desafortunadamente, esto conlleva a escenarios peligrosos por la flamabilidad y explosividad del gas.
Complementario a los métodos físicos de almacenaje de hidrógeno (como la presurización antes descrita), los métodos químicos de almacenaje han tomado mayor relevancia en los últimos años. El uso de hidruros en fase sólida o líquida es una alternativa mucho más segura, presentando la segunda mejores características porque usualmente se libera el hidrógeno en condiciones más suaves. Boranos como el NaBH2, NH3BH3 y el (NH2)2BH3, son alternativas relevantes de interés [23].
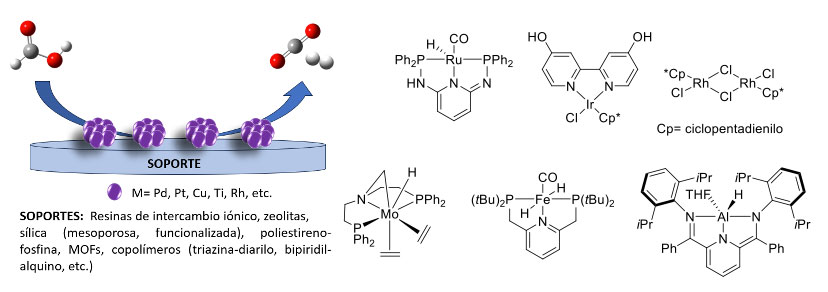
Sin embargo, el ácido fórmico puede ser generado, transportado y utilizado para liberar hidrógeno de manera más conveniente. Por ejemplo, la densidad de almacenamiento de hidrógeno en ácido fórmico es cercana a los 53 g H2/L, que equivale a 1.77 kWh/L. Visto desde una comparativa directa en volumen, un solo litro de ácido fórmico contiene prácticamente 590 litros de hidrogeno. Este perfil químico-energético le permite al ácido fórmico competir con tanques de hidrógeno a alta presión (700 bares) [24], los cuales representan un alto riesgo de seguridad. Las tecnologías más importantes para la generación de hidrógeno a partir de ácido fórmico se basan en su descomposición, utilizando catalizadores a base de metales como Ru, Rh, Ir y Fe, ya sea en catálisis heterogénea (figura 5a) [25] u homogénea (figura 5b) [26]. Cada enfoque catalítico tiene sus propias ventajas y limitaciones. Por ejemplo, en la catálisis homogénea se tiene mejor actividad, pero la recuperación del catalizador resulta más desafiante en comparación con la catálisis heterogénea, que generalmente muestra una menor actividad. Por lo tanto, se han desarrollado nuevas tecnologías en los últimos años para la descomposición catalítica del ácido fórmico que aprovechan las fortalezas de ambos enfoques catalíticos. Un ejemplo de esto son los catalizadores “de un solo átomo” en los que el soporte sólido desempeña un papel crucial como ligante, influyendo las características catalíticas de los metales [27]. También, las tecnologías fotocatalíticas de “separación de agua” han influenciado a la descomposición del ácido fórmico. Por ejemplo, se ha estudiado la producción fotocatalítica de hidrógeno a partir de ácido fórmico utilizando TiO2 [28].
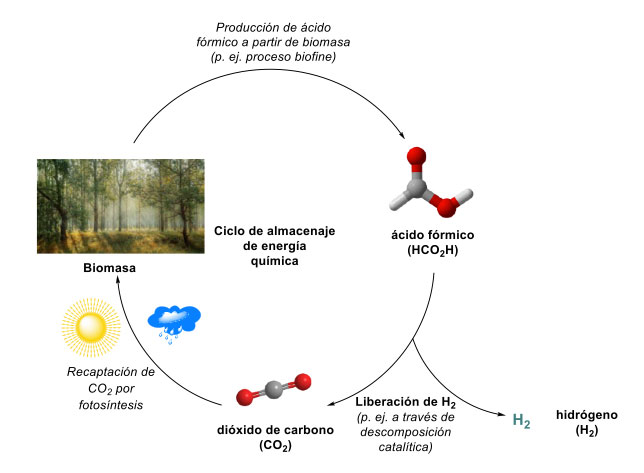
Con el hidrógeno proveniente de ácido fórmico es posible generar energía verde, teniendo como subproducto único al CO2, que se puede reincorporar en ciclos fotosintéticos para regenerar biomasa, de la cual se puede volver a obtener ácido fórmico (figura 6) [29].
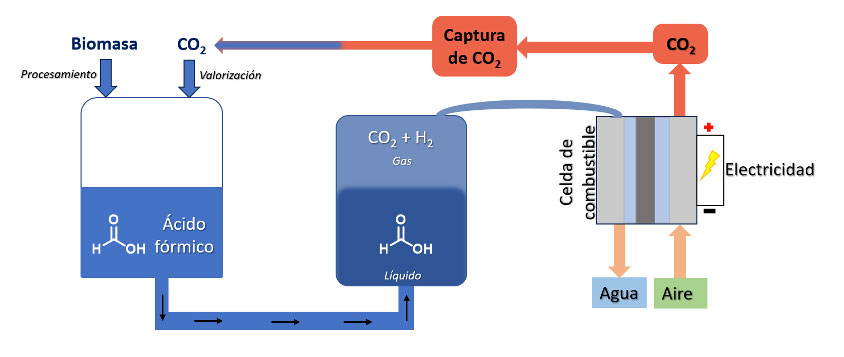
Con base en la producción catalítica de hidrógeno a partir de ácido fórmico, en 2018 se presentó por primera vez una celda de combustible basada en ácido fórmico. Este reactor desarrollado en Suiza [30], utiliza un catalizador basado en rutenio para descomponer al ácido fórmico en hidrógeno y dióxido de carbono. El hidrógeno a su vez es utilizado para generar electricidad, donde el único producto de desecho de la combustión es agua. Esta tecnología ofrece una eficiencia eléctrica de hasta el 45% y una captura prácticamente total del dióxido de carbono (figura 7) [31].
Es importante destacar que las celdas de combustible de ácido fórmico también enfrentan desafíos, como el desarrollo de catalizadores eficientes y la gestión de subproductos. Sin embargo, el interés en esta tecnología sigue creciendo, y se espera que siga mejorando con la investigación y el desarrollo continuos.
Ácido fórmico y sus aplicaciones en síntesis química
En cuanto a su reactividad química, el ácido fórmico es un caso particular a los otros ácidos carboxílicos. No solamente es el más ácido de todos los ácidos carboxílicos simples, sino que presenta reactividad como reductor, con similitud a los aldehídos (Figura 8) [32].
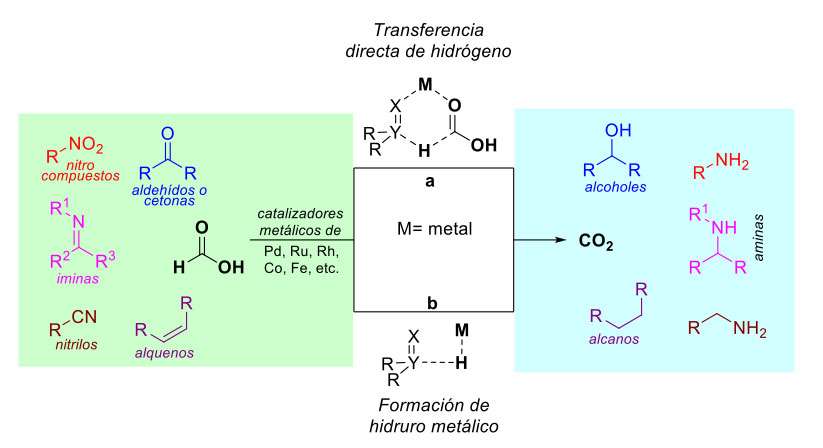
Como se mencionó anteriormente, la descomposición catalítica del ácido fórmico en hidrógeno (H2, vide supra) y dióxido de carbono (CO2) en presencia de metales de transición y en presencia de ácidos y/o bases de Lewis [33], es un recurso químico que permite su uso como fuente de combustible. Sin embargo, para la reducción de diversas especies químicas (figura 9), la evolución del ácido fórmico no necesariamente ocurre hacia la producción de hidrógeno molecular (H2); hay ocasiones en que los átomos de hidrógeno son transferidos a las moléculas que van a ser reducidas. El proceso de transferencia de átomos de hidrógeno a distintas moléculas orgánicas puede llevarse a cabo de dos formas: mediante la transferencia directa de hidrógeno desde el ácido fórmico a la molécula que va a ser reducida (camino a, figura 9), o mediante un proceso multi-paso donde el átomo de hidrógeno es primero transferido a un metal (usualmente un metal de transición) para formar en principio un hidruro metálico, el cual a su vez transferirá a su vez el átomo de hidrógeno a la molécula objetivo (b, figura 9) [34]. De esta forma, se ha conseguido desarrollar metodologías para efectuar la reducción de ácidos carboxílicos, compuestos carbonílicos [35], iminas [36], nitrilos [37], nitro compuestos [38], olefinas [39], entre otros.
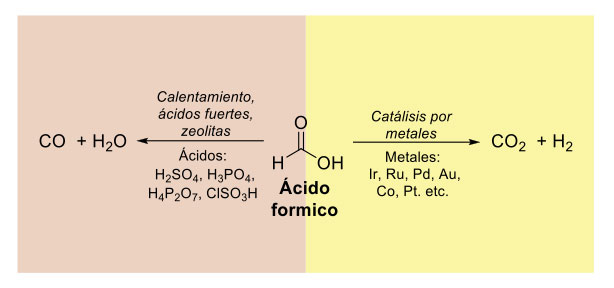
El ácido fórmico también puede dar lugar a otra especie de alto valor, el monóxido de carbono (CO). El monóxido de carbono desempeña un papel crucial en la industria, siendo fundamental para la fabricación de diversos compuestos orgánicos [40], muchos de ellos relevantes en el ámbito farmacéutico [41] y agroquímico [42]. El monóxido de carbono se puede obtener del ácido fórmico a través de su deshidratación con ácidos fuertes, como lo es el ácido sulfúrico [43, 44]. Este modo de descomposición productiva del ácido fórmico, que en esencia es una deshidratación, es complementaria a aquella mencionada anteriormente donde la descomposición conduce a hidrógeno y dióxido de carbono (figura 10).
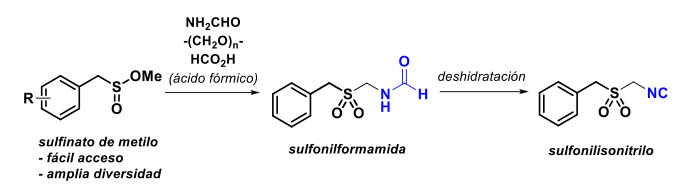
En el Departamento de Química del Cinvestav-Zacatenco, se desarrolla un programa de investigación donde se diseñan e implementan metodologías en las que el ácido fórmico participa en reacciones diversas para sintetizar compuestos de interés. Por ejemplo, se ha logrado acceder a compuestos de tipo N-(arilsulfonilmetil)formamidas (figura 11) [45], las cuales pueden ser útiles para preparar compuestos isonitrílicos [46], que son ampliamente usados para preparar bibliotecas de moléculas nuevas [47], muchas de las cuales tienen una prometedora actividad biológica.
Recientemente, también se presentó un método practico para la desoxigenación de compuestos oxidados de azufre, como sulfinatos de metilo y sulfóxidos [48]. En este método se emplea como catalizador al ión yoduro (que se incorpora como yoduro de potasio), empleando ácido fórmico como agente reductor (figura 12a). El método, que es libre de metales de transición, tiene la singularidad de aprovechar las redes de ácido fórmico que sirven como un andamio molecular, para así efectuar la activación del enlace S-O. (figura 12c). El estudio mecanístico se realizó empleando herramientas de química computacional, y propone que moléculas de ácido fórmico trabajan de manera sinérgica facilitando el proceso de desoxigenación. Así, el método permite la eliminación de oxígeno de compuestos oxidados de azufre usando a un agente reductor sostenible y no ocupa metales pesados o ácidos fuertes. Dado que compuestos de azufre de bajo estado de oxidación son ampliamente encontrados en la industria farmacéutica por ser medicamentos de uso cotidiano, como el fenbendazol y el meropenem, el contar metodologías asequibles para su preparación es deseable.
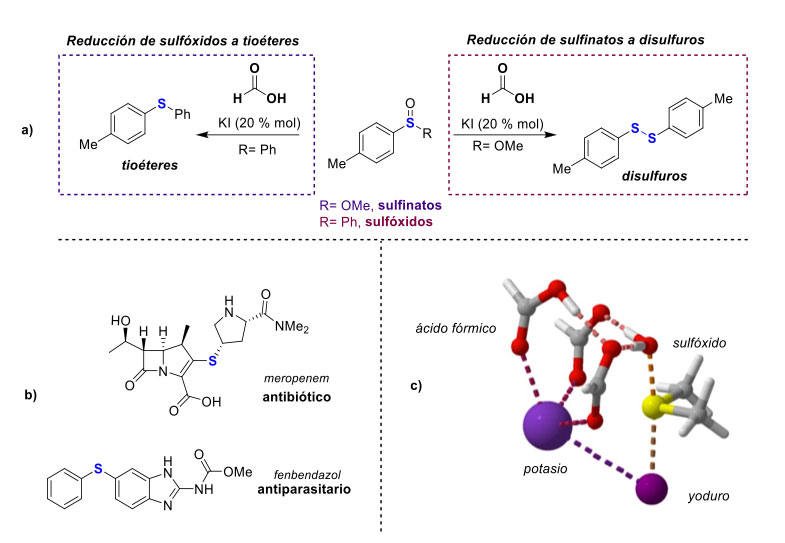
En la actualidad, se sigue trabajando en nuevas metodologías sostenibles para la reducción de otros compuestos empleando ácido fórmico como reductor. Con ello se busca aumentar la “caja de herramientas” de los químicos orgánicos para que se pueda acceder a nuevas moléculas. La diversidad de aplicaciones y las destacadas propiedades fisicoquímicas del ácido fórmico han aumentado el interés en este compuesto. Esto sitúa al ácido fórmico como un compuesto orgánico de gran relevancia en la actualidad. C2
Agradecimientos
Los autores desean expresar su agradecimiento al CONAHCYT por el apoyo económico otorgado a través del proyecto CF-2019-51493.
Referencias
[1] Wray, J. Concerning Some Un-Common Observations and Experiments Made with an Acid Juyce to be Found in Ants. Philos. Trans. Royal Soc. London, 1670, 5, 2063-2066. (John Wray cambió su apellido a Ray a partir de 1670, por razones familiares).
[2] Eisner, T.; Meinwald, Y. C.; Alsop, D. W.; Carrel, J. E. Defense mechanisms of arthropods. XXI. Formic acid and n-nonyl acetate in the defensive spray of two species of Helluomorphoides. Ann. Entomol. Soc. Am. 1968, 61, 610-613.
[3] a) White Jr, J. W. The composition of honey. Bee World, 1957, 38, 57-66; b) Ball, D. W. The chemical composition of honey. J. Chem. Educ. 2007, 84, 1643-1646.
[4] a) Origin of life: Chemistry of seabed’s hot vents could explain emergence of life. https://www.sciencedaily.com/releases/2015/04/150427101635.htm (accesado el 18 de octubre de 2023). b) Roldan, A.; Hollingsworth, N.; Roffey, A.; Islam, H.-U.; Goodall, J. B. M.; Catlow, C. R. A.; Darr, J. A.; Bras, W.; Sankar, G.; Holt, K. B.; Hogarth, G.; de Leeuw, N. H. Bio-inspired CO2 conversion by iron sulfide catalysts under sustainable conditions. Chem. Commun. 2015; 51 (35), 7501-7504.
[5] Bockelée-Morvan, D.; Lis, D. C.; Wink, J. E.; Despois, D.; Crovisier, J.; Bachiller, R. New molecules found in comet C/1995 O1 (Hale-Bopp). Investigating the link between cometary and interstellar material. Astron. Astrophys. 2000, 353, 1101–1114.
[6] El ácido fórmico es considerado por las Naciones Unidas como un líquido clase 8 (corrosivo) de riesgo medio (grupo II).
[7] pKa es el parámetro fisicoquímico que indica la fuerza de un ácido: aquellos con valores menores a 3, son considerados ácidos fuertes. Los ácidos de fuerza media (y débiles) presentan un pKa de 3 a 7. El ácido fórmico presenta un pKa de 3.75 mientras que al ácido acético corresponde un pka de 4.76.
[8] Liu, X.; Li, S.; Liu, Y.; Cao, Y. Formic acid: A versatile renewable reagent for green and sustainable chemical synthesis. Chinese J. Catal. 2015, 36, 1461–1475.
[9] a) Pelouze J. Sur la Transformation de l Acide Hydrocyanique et des Cyanures en Ammoniaque et en Acide Formique. Ann. Chim. 1831, 48, 395-402; b) Wisniak, J. Théofile-Jules Pelouze. Glass, wine and explosives. Revista CENIC. Ciencias Químicas, 2002, 33, 87-94.
[10] Dixon, H. B. Berthelot Memorial Lecture. J. Chem. Soc., Trans. 1911, 99, 2353-2371.
[11] a) Berthelot. Ueber die Bildung von Ameisensäure aus Kohlenoxydgas. Justus Liebigs Ann. Chem. 1856, 97(1), 125-125; b) Berthelot. Umwandlung des Kohlenoxyds in Ameisensäure. J. Prakt. Chem. 1856, 68(1), 146-149.
[12] La fuente principal del monóxido de carbono es el carbón de coque.
[13] Reutemann, W.; Kieczka, H. Formic acid. En Ullmann’s encyclopedia of industrial chemistry, 2011, Ed. Wiley-VCH, 16, 67-82.
[14] Houache, M. S.; Safari, R.; Nwabara, U. O.; Rafaïdeen, T.; Botton, G. A.; Kenis, P. J.; … & Baranova, E. A. Selective Electrooxidation of Glycerol to Formic Acid over Carbon Supported Ni1–x M x (M= Bi, Pd, and Au) Nanocatalysts and Coelectrolysis of CO2. ACS Appl. Energy Mater. 2020, 3(9), 8725-8738; b) Xu, J.; Zhang, H.; Zhao, Y.; Yu, B.; Chen, S.; Li, Y.; Liu, Z. Selective oxidation of glycerol to lactic acid under acidic conditions using AuPd/TiO2 catalyst. Green Chem. 2013, 15(6), 1520-1525; c) Lin, Y. T.; Yang, J.; Mou, C. Y. Highly selective conversion of glycerol to formic acid over a synergistic Au/phosphotungstic acid catalyst under nanoconfinement. ACS Sustain. Chem. Eng. 2021, 9(9), 3571-3579.
[15] https://www.marketsandmarkets.com/Market-Reports/formic-acid-Market-69868960.html, (accedido en octubre 03, 2023).
[16] a) Zhang, J.; Sewell, C. D.; Huang, H.; Lin, Z. Closing the Anthropogenic Chemical Carbon Cycle toward a Sustainable Future via CO2 Valorization. Adv. Energy Mater. 2021, 11(47), 2102767; b) Chery, D.; Lair, V.; Cassir, M. Overview on CO2 valorization: challenge of molten carbonates. Front. Energy Res. 2015, 3, 43.
[17] a) Hayes, D. J.; Fitzpatrick, S.; Hayes, M. H.; Ross, J. R. Capítulo 7. The biofine process–production of levulinic acid, furfural, and formic acid from lignocellulosic feedstocks. En Biorefineries–Industrial Processes and Product, 2006, 1, 139-164; b) Fitzpatrick, S. W. Capítulo 20. The Biofine technology: A” bio-refinery” concept based on thermochemical conversion of cellulosic biomass. [ACS Symposium Series] Feedstocks for the Future Volume 921 (Renewables for the Production of Chemicals and Materials), 2006, pp 271-287.
[18] Una sustancia química de plataforma es aquella que sirve como sustrato para producir otros productos químicos de valor agregado.
[19] A diferencia de otros procesos de digestión de celulosa, el proceso biofine no utiliza tecnología enzimática, lo cual usualmente da lugar a rendimientos bajos y el rango de sustratos es limitado.
[20] Nnabuife, S. G.; Oko, E.; Kuang, B.; Bello, A.; Onwualu, A. P.; Oyagha, S.; Whidborne, J. The Prospects of Hydrogen in Achieving Net Zero Emissions by 2050: A Critical Review. Sustain. Chem. Clim. Action 2023, 2, 100024.
[21] https://www.openaccessgovernment.org/blue-hydrogen-fossil-fuels-climate/133787/ (consultado el 1 de noviembre de 2023).
[22] Temperatura de 20 °C a 1 atm de presión
[23] Yadav, M.; Xu, Q.; Liquid-phase chemical hydrogen storage materials. Energy Environ. Sci. 2012, 5, 9698-9725.
[24] a) Chen, X.; Liu, Y.; Wu, J. Sustainable production of formic acid from biomass and carbon dioxide. Mol. Catal. 2020, 483, 110716; b) Eppinger, J.; Huang, K. W. Formic acid as a hydrogen energy carrier. ACS Energy Lett. 2017, 2, 188-195.
[25] Bulushev, D. A. Progress in Catalytic Hydrogen Production from Formic Acid over Supported Metal Complexes. Energies 2021, 14 (5), en14051334.
[26] Sordakis, K.; Tang, C.; Vogt, L. K.; Junge, H.; Dyson, P. J.; Beller, M.; Laurenczy, G. Homogeneous Catalysis for Sustainable Hydrogen Storage in Formic Acid and Alcohols. Chem. Rev. 2018, 118 (2), 372–433.
[27] Bulushev, D. A.; Bulusheva, L. G. Catalysts with Single Metal Atoms for the Hydrogen Production from Formic Acid. Catal. Rev. – Sci. Eng. 2022, 64 (4), 835–874.
[28] Suhag, M. H.; Tateishi, I.; Furukawa, M.; Katsumata, H.; Khatun, A.; Kaneco, S. Photocatalytic Hydrogen Production from Formic Acid Solution with Titanium Dioxide with the Aid of Simultaneous Rh Deposition. ChemEngineering 2022, 6 (3), 43. https://doi.org/10.3390/chemengineering6030043.
[29] Park, J. H.; Lee, D. W.; Jin, M. H.; Lee, Y. J.; Song, G. S.; Park, S. J.; Choi, Y. C. Biomass-formic acid-hydrogen conversion process with improved sustainability and formic acid yield: Combination of citric acid and mechanocatalytic depolymerization. Chem. Eng. J. 2021, 421, 127827.
[30] La celda de combustible HYFORM-PEMFC fue un proyecto financiado por la Oficina Federal Suiza de Energía y una compañía privada (Grupo GRT). El desarrollo estuvo liderado por el Profesor Gabor Laurenczy (retirado en 2019) en la Escuela Politécnica Federal de Lausanne (EPFL). https://actu.epfl.ch/news/the-world-s-first-formic-acid-based-fuel-cell/ (accesado el 8 de noviembre de 2023). Lamentablemente, hasta 2020 no existe registro de patente o publicación que detalle esta tecnología.
[31] Ma, Z.; Legrand, U.; Pahija, E.; Tavares, J. R.; Boffito, D. C. From CO2 to formic acid fuel cells. Ind. Eng. Chem. Res. 2021, 60, 803–815.
[32] Gibson, H. W. Chemistry of Formic Acid and Its Simple Derivatives. Chem. Rev. 1969, 69 (5), 673–692.
[33] Grasemann, M.; Laurenczy, G. Formic acid as a hydrogen source – recent developments and future trends. Energy Environ. Sci. 2012, 5, 8171-8181.
[34] Gladiali, S.; Alberico, E. Asymmetric transfer hydrogenation: chiral ligands and applications. Chem. Soc. Rev. 2006, 35, 226-236.
[35] Wienhoefer, G., Westerhaus, F. A.; Junge, K.; Beller, M. J. Fast and selective iron-catalyzed transfer hydrogenations of aldehydes. Organomet. Chem. 2013, 744, 156-159
[36] Ejemplos selectos: a) Li, J.; Zhang, Y.; Han, D.; Gao, Q.; Li, C. Asymmetric transfer hydrogenation using recoverable ruthenium catalyst immobilized into magnetic mesoporous silica. J. Mol. Catal. A: Chem. 2009, 298, 31-35; b) Chen, H. Y. T.; Wang, C.; Wu, X.; Jiang, X.; Catlow, C. R. A.; Xiao; Iridicycle-Catalysed Imine Reduction: An Experimental and Computational Study of the Mechanism. J. Chem. Eur. J. 2015, 21, 16564-16577; c) Shende, V. S.; Deshpande, S. H.; Shingote, S. K.; Joseph, A.; Kelkar, A. A. Asymmetric transfer hydrogenation of imines in water by varying the ratio of formic acid to triethylamine. Org. Lett. 2015, 17, 2878-2881.
[37] Ejemplos selectos: a) Vilches-Herrera, M.; Werkmeister, S.; Junge, K.; Börner, A.; Beller, M. Selective catalytic transfer hydrogenation of nitriles to primary amines using Pd/C. Catal. Sci. Technol. 2014, 4, 629-632; b) Tomar, P.; Nozoe, Y.; Ozawa, N.; Nishimura, S.; Ebitani, K. Formic Acid as a Hydrogen Source for the Additive-Free Reduction of Aromatic Carbonyl and Nitrile Compounds at Reusable Supported Pd Catalysts. Catalysts, 2020, 10(8), 875.
[38] Ejemplos selectos: a) Jagadeesh, R. V.; Banerjee, D.; Arockiam, P. B.; Junge, H.; Junge, K.; Pohl, M. M.; …& Beller, M. Highly selective transfer hydrogenation of functionalised nitroarenes using cobalt-based nanocatalysts. Green Chem. 2015, 17, 898-902; b) Rhee, E. S.; Shine, H. J. Heavy-atom kinetic isotope effects and mechanism of the acid-catalyzed o-semidine and p-semidine rearrangements and disproportionation of 4,4′-dichlorohydrazobenzene. J. Am. Chem. Soc. 1986, 108(5), 1000-1006; c) Basu, B.; Das, P.; Das, S. Transfer hydrogenation using recyclable polymer-supported formate (PSF): Efficient and chemoselective reduction of nitroarenes. Mol. Divers. 2005, 9, 259-262.
[39] Gong, L. H.; Cai, Y. Y; Li, X. H.; Zhang, Y. N.; Su, J.; Chen, J. S. Room-temperature transfer hydrogenation and fast separation of unsaturated compounds over heterogeneous catalysts in an aqueous solution of formic acid. Green Chem. 2014, 16(8), 3746-3751.
[40] Ejemplos selectos: Precise Supramolecular Control of Selectivity in the Rh-Catalyzed Hydroformylation of Terminal and Internal Alkenes Dydio, P.; Detz, R. J.; Reek, J. N. H. J. Am. Chem. Soc. 2013, 135, 10817–10828.; Synthesis of Heterocycles via Palladium-Catalyzed Carbonylations. Wu, X.-F.; Neumann, H.; Beller, M. Chem. Rev. 2013, 113, 1–35.; Evidence of Highly Active Cobalt Oxide Catalyst for the Fischer–Tropsch Synthesis and CO2 Hydrogenation Melaet, G.; Ralston, W. T.; Li, C.-S.; Alayoglu, S.; An, K.; Musselwhite, N.; Kalkan, B.; Somorjai, G. A. J. Am. Chem. Soc. 2014, 136, 2260–2263.
[41] Large-Scale Applications of Transition Metal-Catalyzed Couplings for the Synthesis of Pharmaceuticals Magano. J.; Dunetz, J. R. Chem. Rev. 2011, 111, 2177–2250.
[42] Carrilho, R. M. B.; Calvete, M. J. F.; Mikle, G.; Kollár, L.; Pereira, M. M. Chin. J. Chem. 2023, 42, 199-221.
[43] Ejemplos selectos: Mossman, A. L. Method for continuous manufacture of carbon monoxide. US2996359A, 1961.
[44] Desafortunadamente este método de generación de CO ha sido utilizado para intentos de autolesión: a) Ershad, M.; Melisiotis, A.; Gaskill, Z.; Kelly, M.; Hamilton, R. An Unusual Case of Carbon Monoxide Poisoning from Formic and Sulfuric Acid Mixture. Clin. Pract. Cases Emerg. Med. 2019, 4 (1), 51–54. b) Yang, C.-C.; Ger, J.; Li, C.-F. Formic Acid: A Rare but Deadly Source of Carbon Monoxide Poisoning. Clin. Toxicol. 2008, 46 (4), 287–289.
[45] Tapia-Pineda, A.; Perez-Arrieta, C.; Silva-Cuevas, C.; Paleo, E.; Lujan-Montelongo, J. A. The two faces of sulfinates: illustrating umpolung reactivity. J. Chem. Educ. 2016, 93(8), 1470-1474.
[46] Lujan-Montelongo, J. A.; Estevez, A. O.; Fleming, F. F. Alkyl Sulfinates: Formal Nucleophiles for Synthesizing TosMIC Analogs. Eur. J. Org. Chem. 2015, (7), 1602–1605.
[47] Gao, L.; Shaabani, S.; Reyes Romero, A.; Xu, R.; Ahmadianmoghaddam, M.; Dömling, A. ‘Chemistry at the speed of sound’: automated 1536-well nanoscale synthesis of 16 scaffolds in parallel. Green Chem. 2023, 25, 1380–1394.
[48] Montelongo, J. A. L.; de la Cuesta, L. J. G.; Cruz-Jiménez, A. E.; Hernández, P. E.; Vela, A. Introducing I−/formic acid as a green reagent for the reduction of sulfinates and sulfoxides. Green Chem. 2023, 25, 7963-7970.