Cada año mueren miles de personas en el mundo debido a alguna infección producida por ingerir alimentos contaminados. Entre los agentes patógenos más comunes se encuentra la bacteria Escherichia coli.
Para lograr la eliminación de la E. coli se han desarrollado métodos alternativos al convencional por pasteurización, produciendo mínimas alteraciones en la calidad de los alimentos. Algunos de los procedimientos más usados consisten en la aplicación de radiación ionizante, campos eléctricos pulsados, plasmas y altas presiones hidrostáticas (HHP). Este último ha sido de los más prometedores, aunque tiene la desventaja de utilizar un equipo sofisticado y costoso.
El método HHP consiste en la aplicación de cambios de presión y temperatura.
El método HHP consiste en la aplicación de cambios de presión y temperatura en el producto alimenticio, provocando de manera indirecta la muerte de la E. coli. La identificación del blanco celular y los mecanismos que provocan la muerte de la bacteria han sido las interrogantes elementales por responder. El daño provocado en la membrana celular, en el método del HHP, parece ser la causa determinante que aniquila a la E. coli.
¿Qué ocurrirá a temperaturas muy por debajo de los cero grados centígrados?
Como una consecuencia de nuestro interés por comprender las propiedades e interacciones físicas del agua, propusimos recientemente un procedimiento sencillo para la eliminación de la E. coli. El método se basa en la generación de altas presiones en el cultivo celular mediante su enfriamiento.
¿Cuál es entonces la diferencia con el método HHP? La diferencia es que no se aplica ninguna presión externa sobre el contenedor. Las altas presiones a las que son sometidas las bacterias se desarrollan en el medio en el que éstas se encuentran inmersas. Para ello es necesario que el volumen del contenedor no cambie durante el proceso de enfriamiento; es decir, se requieren condiciones isocóricas. Podría usted imaginarse ¿cómo afectará la temperatura de enfriamiento en la mortalidad de la bacterias?, es decir, ¿qué ocurrirá a temperaturas muy por debajo de los 0 oC?, y ¿qué pasará si no ponemos restricciones en el volumen? Apoyados en la intuición, podemos responder rápidamente algunas o todas las preguntas. Veamos que tan certeras serían sus respuestas comparando con las evidencias experimentales.
Consideremos dos contenedores de acero idénticos donde se vierte el medio de cultivo. El primero lo llenamos hasta un 90% de su volumen, el segundo al 100%. Los dos son sellados herméticamente y sometidos a enfriamiento. En un primer experimento enfriamos hasta -15 oC, en otro experimento hasta -20 oC, y por último, hasta -30 oC (en cada caso se tiene una muestra control a la que no se le hace nada).
El medio de cultivo del primer contenedor, enfriado a cualquiera de las tres temperaturas, siempre se cristalizará en el hielo que todos conocemos. En efecto, este hielo llamado hielo hexagonal (Ih), cuya estructura la determinan los puentes de hidrógeno que unen a las moléculas de agua, creando una red hexagonal abierta con grandes espacios vacíos que no existían en estado líquido, se expandirá un 10% más de su volumen y su densidad disminuirá.
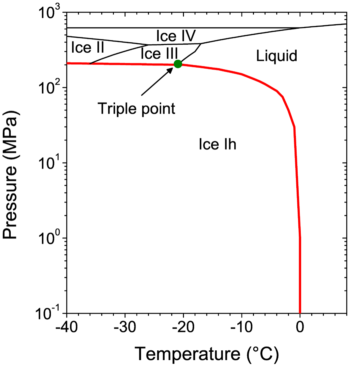
Lo que ocurre en el experimento del contenedor lleno al 100% (caso isocórico) es todavía más interesante. A medida que el medio de cultivo se va enfriando hasta alcanzar cualquiera de las temperaturas mencionadas, el agua irá ejerciendo una presión sobre todas las superficies internas del contenedor, tratando de expandirse. El resultado es que no se cristalizará… en hielo Ih. En su lugar surgirá otro estado del agua que sigue el diagrama de fases de esta sustancia (ver Fig. 1). De acuerdo con él, la trayectoria termodinámica que sigue el líquido en esta situación es la línea de coexistencia roja de la figura, en la que se puede tener simultáneamente la fase líquida y sólida del agua. De hecho, este comportamiento lo describe la ecuación de Clausius-Clapeyron: dP/dT =ΔH/TΔV, donde P, T, H y V son la presión, temperatura, entalpía [1] y volumen, respectivamente. Es claro que en condiciones de hermeticidad total, la presión se incrementa considerablemente debido a que el volumen no cambia (ΔV=0). El diagrama de fases indica que seguiremos teniendo agua líquida hasta aproximadamente una presión de 210 MPa (a -24 oC), cuando se alcanza un punto triple (punto donde coexisten tres fases simultáneamente; punto verde en la Fig. 1). Como el volumen y la masa no varían, la densidad del medio tampoco cambia. Así, en este punto triple lo que ocurre es que un cascarón de hielo III empieza a formarse sobre las superficies internas del contenedor, debido a la alta presión que se ejerce sobre ellas. El hielo III tiene la característica de crearse a base de cristales tetragonales y ser más denso que el agua. De ahí que al momento en que éste se empieza a formar en las paredes del contenedor, surge un espacio para que una capa de hielo lh (menos denso que el agua) se forme simultáneamente. Resulta interesante que a esta temperatura de -24 oC, el agua sigue existiendo en forma líquida, pues es la que ejerce la presión que provoca que el hielo III comience a formarse. Sin embargo, debido a estas condiciones, es una agua más viscosa que la que conocemos.
Hasta ahora, sólo hemos analizado los resultados de la solución en la que se encuentra el cultivo, pero ¿qué pasa con las bacterias?
Al analizar la replicación de éstas, después del enfriamiento a las tres diferentes temperaturas, encontramos que en el caso del contenedor totalmente lleno, hay un notable contraste entre los resultados a -15 oC, con respecto a las otras dos temperaturas. Mientras en el primero la replicación es totalmente nula, a -20 y -30 oC sí la hay, y ésta puede llegar a ser hasta un 50 y 35%, respectivamente, con respecto al caso que no se sometió a enfriamiento. ¿Coinciden estos resultados experimentales con lo que usted predecía?
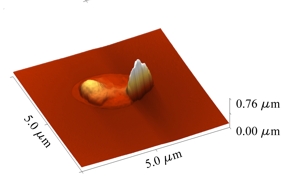
Una mirada de cerca a los efectos que producimos con el enfriamiento isocórico a -15 oC la tenemos en la imagen tomada con microscopía de fuerza atómica (Fig. 2a). Es evidente el cambio tan drástico en las dimensiones de la bacteria comparado con el caso control (Fig.2b): la ruptura de su membrana y la salida del material celular. Mientras que para las otras dos temperaturas los efectos no son tan severos (así que no los ilustramos).

¿Cómo sucedió este inesperado desenlace? En el caso del experimento con el contenedor lleno al 90%, el resultado es una cristalización convencional que provoca un estrés osmótico en la célula, pero sin aniquilarla por completo. En el caso del enfriamiento isocórico a -15 oC, que es el caso menos previsible, la bacteria se encuentra en un ambiente metaestable (descrito por la línea de coexistencia de fases roja), en donde no se puede formar el hielo y el líquido ejerce una presión tal, que causa el exterminio de las bacterias. En contraste, a -20 y -30 oC la destrucción parcial que se observa de la E. coli se debe a que a estas temperaturas la formación simultánea de hielo III y hielo Ih causan la muerte de una parte de la población, mientras que otra parte se resguarda dentro de estos hielos. Así, después del proceso de enfriamiento, las bacterias sobrevivientes continúan su replicación.
Como conclusión, si queremos exterminar completamente a las bacterias con este sencillo método, no se requiere llegar a temperaturas muy bajas, pues de hacerlo estaríamos proporcionándoles un refugio para sobrevivir. C2
Referencias:
[1] La entalpía es la energía interna del sistema.
Los detalles sobre estos resultados se encuentran en PlosOne, (2015), DOI:10.1371/journal.pone.0140882.