En convenio con C&EN, la publicación original se encuentra en su portal
Conforme se relaja el confinamiento, los países afectados por la COVID-19 se enfrentan a un dilema. La gente quiere volver a sus puestos de trabajo y a las escuelas, pero la vuelta a la normalidad podría suponer una nueva oleada de infecciones, un riesgo catastrófico.
Una forma de reducir ese riesgo es aumentar el número de análisis diagnósticos. Hasta ahora, la mayoría de tests de coronavirus se han realizado con muestras de personas con síntomas de COVID-19 como tos o fiebre. Pero la mayoría de infectados son asintomáticos y podrían infectar a más gente. Los oficiales de salud pública esperan luchar contra esta amenaza oculta desarrollando pruebas que puedan detectar pacientes asintomáticos en residencias, universidades y aeropuertos. “Si no hacemos test a los asintomáticos, no pararemos el avance del virus,” dice Bruce J. Tromberg, que lidera parte de la iniciativa “Aceleración rápida de los diagnósticos” (RADx, por sus siglas en inglés) del Instituto Nacional de Salud de los EE.UU.
Para satisfacer la enorme demanda, EE.UU., Reino Unido y la UE están invirtiendo en test de diagnóstico que puedan usarse en el día a día sin necesidad de laboratorios especializados, para que las personas potencialmente contagiosas y sus contactos puedan identificarse y aislarse más rápidamente. “Necesitamos test moleculares de mejor calidad, especialmente en aparatos rápidos y portátiles,” dice Sergio Carmona, jefe de acceso en la Fundación para Nuevos Diagnósticos Innovadores (FIND, por sus siglas en inglés), una organización sin ánimo de lucro global con sede en Ginebra.
Un perfil exigente
El 5 de agosto, la OMS anunció las especificaciones que deberían cumplir los tests rápidos. Entre ellas están una sensibilidad (tasa de positivos verdaderos) de más del 70% y una especificidad (tasa de negativos verdaderos) de al menos 97%, con resultados garantizados en menos de 40 minutos. Cada test debería costar menos de 20 dólares y utilizar máquinas que puedan comprarse por menos de 3000 dólares. Además, los métodos tienen que ser suficientemente simples como para que puedan realizarlos usuarios con apenas unas horas de entrenamiento.
Los test rápidos también tienen que funcionar de forma fiable fuera del laboratorio, según Hakho Lee, que desarrolla tecnologías diagnósticas para el Instituto de Investigación del Hospital General de Massachusetts. “Los test de ácidos nucleicos, sobre todo, tienen que tener barreras para evitar la contaminación,” porque son tan sensibles que pueden detectar ácidos nucleicos de otras fuentes, explica.
Muy pocos test de COVID-19 actuales cumplen estos requisitos. Las tecnologías que detectan el ARN viral en muestras de la nariz o la garganta de los pacientes suelen depender de la reacción en cadena de la transcriptasa-polimerasa (RT-PCR), que usa enzimas para transformar el ARN a ADN y luego hacer copias del material genético para que pueda detectarse. Es el estándar para detectar infecciones actualmente, pero los test de PCR requieren técnicos muy preparados, así como trabajar en laboratorios especializados, algo que es muy lento para llevar a cabo ensayos en masa y diagnosticar a personas asintomáticas.
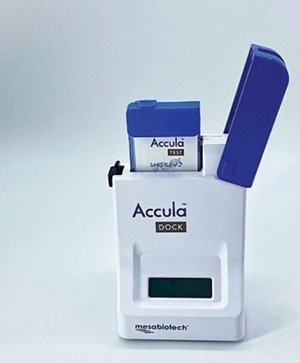
El sistema “Accula” de Mesa Biotech usa RT-PCR para detectar SARS-CoV-2 en menos de 30 minutos.
Las pruebas de antígenos que detectan las proteínas del virus podrían ser baratas y portátiles, pero por lo general nunca son tan precisas como los tests de ácidos nucleicos. Además, los tests que detectan la respuesta inmune al virus solo detectan los anticuerpos alrededor de una semana después de que el paciente desarrolla síntomas de la enfermedad.
Para resolver este problema, necesitamos tests más rápidos, portátiles y fáciles de operar que puedan detectar el ARN viral. Ahora mismo existen algunas opciones, como el ID Now de Abbott y el Xpert Xpress de Cepheid. Ambos funcionan en máquinas del tamaño de una tostadora y detectan SARS-CoV-2 en menos de una hora. Pero aunque estas empresas amplíen su producción, Tromberg no cree que vaya a ser suficiente para cubrir las necesidades de EE.UU. “Necesitamos más opciones para reducir la presión en el mercado,” dice.
Para estimular la competencia, RADx anunció el 31 de julio que dispondría de 248.7 millones de dólares para el desarrollo de siete herramientas de diagnóstico de COVID-19, seleccionadas entre más de 600 tecnologías (N. Engl. J. Med. 2020, DOI: 10.1056/NEJMsr2022263). Tres de esas siete son pruebas rápidas.
El sistema “Accula” de Mesa Biotech es un dispositivo portátil que automatiza el proceso de RT-PCR. Se alimenta con un pequeño cartucho con la muestra y utiliza un dispositivo de lectura de flujo lateral – como un test de embarazo – para indicar los resultados en unos 30 minutos. Cada dispositivo cuesta unos cientos de dólares, y los cartuchos cuestan alrededor de 20 dólares. Actualmente hay unos 2000 dispositivos en uso y la empresa fabrica 140.000 cartuchos al mes. Ahora, la ayuda de RADx permitirá ampliar la producción.
“Talis One” de Talis Biomedical utliza un método llamado amplificación isoterma en bucle (LAMP, por sus siglas en inglés) y da resultados en menos de 30 minutos. En una RT-PCR, se utilizan ciclos de distintas temperaturas para romper la doble hebra del ADN y luego amplificar los ácidos nucleicos. Sin embargo, la RT-LAMP usa una ADN polimerasa que puede separar las hebras de ADN gracias a pequeños fragmentos de ácidos nucleicos llamados primers. Estos, enhebran las cadenas en unos bucles que permiten la amplificación a una temperatura constante de 65 ºC, lo que simplifica el proceso y el equipo necesarios para la reacción.

El test “Talis One” recibirá más de 25 millones de dólares de la iniciativa RADx para aumentar la producción de su sistema de detección de ARN viral.
El tercer dispositivo de test rápido es Sofia 2, de Quidel, un test de antígenos que da los resultados en menos de 15 minutos. Utiliza anticuerpos en una cinta de flujo lateral que se ancla a las proteínas del virus en la muestra y genera una señal fluorescente.
Aunque se han detectado algunos problemas con la precisión tanto de Sofia 2 como de Accula (J. Clin. Microbiol. 2020, DOI: 10.1128/JCM.01072-20), Tromberg dice que han funcionado bien en los “exhaustivos procesos de validación” que llevó a cabo la RADx durante el proceso de selección.

El dispositivo “Sofia 2” de Quidel puede detectar proteínas y antígenos de SARS-CoV-2 y podría utilizarse en residencias de ancianos. Acaba de recibir 71 millones de dólares de RADx.
Los resultados de esta validación todavía no son públicos. Pero, conforme los tests vayan creciendo y la incidencia de la enfermedad, esperemos, baje, será más importante que los tests sean muy específicos, dice Jonathan J. Deeks, un médico estadístico de la Universidad de Birmingham. “Cuando desciende la prevalencia, si la especificidad no es cercana al 100%, muchos tests estarán dando falsos positivos,” explica.
Tromberg estima que, con los métodos actuales, EE.UU. tendrá capacidad de llevar a cabo 2.6 millones de test COVID-19 al día a final de año. Con la ayuda de las nuevas tecnologías facilitadas por la RADx, sería posible incluso llegar a 6 millones de test diarios, dice.
Falta de transparencia
Otros gobiernos también están invirtiendo en el desarrollo de test rápidos. La UE, a través de su programa Horizonte 2020, ha contribuido casi 47 millones de dólares para el desarrollo de una gran variedad de test para COVID-19. Estos incluyen el “HG COVID-19” de Hibergene, otra tecnología portátil basada en LAMP-PCR que puede dar resultados en 30 minutos. El test de Hibergene está en el mercado desde finales de mayo.
El gobierno del Reino Unido anunció el 3 de agosto que empezaría a usar dos test rápidos en residencias de ancianos. Ambos ofrecen resultados en menos de 90 minutos y empezarán a utilizarse en septiembre.

El test LamPORE de Oxford Nanopore, que funciona en su aparato GridION (arriba) está listo para utilizarse a gran escala en Reino Unido.
Uno de los test, “LamPORE” de Oxford Nanopore, usa LAMP para amplificar secuencias de ácidos nucleicos del virus. Estos test pueden utilizarse en los aparatos “GridION”, de escritorio, y “MinION”, portátil, que identifican las secuencias de SARS-CoV-2 pasando el ADN amplificado a través de un nanoporo de proteínas. Cuando las cadenas de ADN pasan por el poro generan pequeñas diferencias de potencial que pueden relacionarse con la secuencia de bases. El gobierno de Reino Unido ha comprado 450.000 test por un precio que no ha revelado.
El otro método lo desarrolla DnaNudge, una empresa que normalmente ofrece servicios para detectar la predisposición genética de pacientes para enfermedades como la obesidad o la diabetes de tipo 2 y luego da consejos de salud y estilo de vida personalizados. En marzo, crearon un ensayo de SARS-CoV-2 para sus dispositivos de RT-PCR portátiles, y el gobierno de Reino Unido acaba de comprarles 5.8 millones de kits para test por 210 millones de dólares.
Tanto LamPORE como el ensayo de DnaNudge han pasado ensayos clínicos, aunque los resultados de estos todavía no son públicos. Tampoco existen apenas detalles sobre cómo se utilizan los tests o cómo los ha seleccionado el gobierno de Reino Unido. “El proceso de toma de decisiones no es transparente,” dice Deeks. Hasta que esta información sea pública, es difícil evaluar el impacto que tendrán estos métodos en el Reino Unido. C2